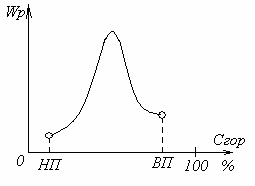
В умовах промислового спалювання палива зазвичай стан рівноваги не наступає. Швидкість реакції можна визначити за швидкістю перетворення будь-якого з реагентів, тому швидкість згоряння палива можна виразити через швидкість витрачання горючих елементів або палива в цілому, а також через швидкість витрачання окислювача або швидкість утворення продуктів згоряння.
Залежність швидкості хімічної реакції від температури
Зі збільшенням температури швидкість хімічної реакції горіння зростає. Для знаходження залежності швидкості хімічної реакції від температури досить визначити температурну залежність константи. Ця залежність виражається законом Арреніуса.
де Е - енергія активації (кДж / моль), R - газова постійна (8,314 кДж / моль), kо - предекспоненціальний множник (загальне число зіткнень молекул), Т - абсолютна температура процесу.
Енергія достатня для руйнування внутрішньомолекулярних зв'язків вихідних речовин, називається енергією активації. Чим вище рівень енергії активації, тим повільніше швидкість реакції.
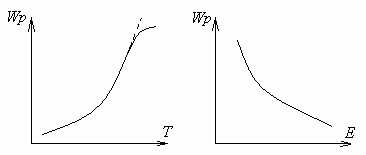
Малюнок 1.7 - Залежність швидкості реакції від температури і енергії активації
Енергія активації є головним фактором, що визначає швидкість реакції: чим менше енергія активації, тим вище швидкість.
Залежність швидкості хімічної реакції від концентрації суміші