Метали і Сварка
Кулонівські сили тяжіння, що виникають при взаємодії заряджених іонів, сильні і діють однаково у НД ?? ех напрямах. В результаті цього розташування іонів упорядковується в просторі определ ?? енним чином, утворюючи іонну кристалічну решітку. Речовини з іонної КР при звичайних умовах знаходяться в кристалічному стані, вони мають високі температури плавлення і кипіння.
Метали і їх сплави кристалізуються у формі металевих решіток. Вузли в металевій решітці зайняті позитивними іонами металів. Валентні електрони, які відокремилися від атомів металів і залишилися в вузлах кристалічної решітки іони, більш-менш вільно переміщаються в просторі між катіонами і обумовлюють електричну провідність металів. Між іонами і вільними електронами виникають електростатичні взаємодії, які і є причиною виникнення металевого зв'язку.
Металева зв'язок має схожість як з іонним (утворюється за рахунок взаємодії між зарядженими частинками: електронами і іонами), так і з ковалентним (відбувається усуспільнення електронів, але на відміну від ковалентного зв'язку, де електрони локалізовані близько определ ?? енних атомів, електрони в металах усуспільнюється для вс ?? його кристала). Вільні електрони іноді називають електронним газом. Катіони в металевих гратах не володіють поступальним рухом, а роблять коливання навколо положення вузлів решітки. Амплітуда цих коливань зростає при підвищенні температури, а при досягненні температури плавлення металу решітка руйнується. Температура плавлення металів, як правило зростає зі збільшенням числа валентних електронів в їх атомах.
Суміші двох або більше індивідуальних металів називаються сплавами. У сплавах можуть бути присутніми в невеликих кількостях і деякі неметали (вуглець, сірка, кремній). Поширеним методом отримання сплавів є спільне нагрівання їх складових частин до повного розплавлення суміші. При цьому деякі метали не сплавляються один з одним в будь-яких відносинах. Металеві сплави можна класифікувати так: тверді розчини впровадження (частина межузельних порожнин решітки зайнята атомами іншого елемента͵ наприклад атоми вуглецю в жел ?? Езе-чавун і сталі); тверді розчини заміщення (частина атомів основної речовини замінена на атоми примесного елемента-олов'яний припій-64 частини олова і 36-свинцю); суміші індивідуальних кристалів металів; суміші кристалів інтерметаліческіх з'єдн ?? ень (сплавляли метали утворюють хімічні з'єдн ?? ення-в бронзі присутній з'єдн ?? ення Cu3 Sn)
Ван-дер-ваальсово сили - сили міжмолекулярної (і межатомного) взаємодії з енергією 10 - 20 кДж / моль. Цим терміном спочатку позначалися нд ?? е такі сили, в сучасній науці він зазвичай застосовується до сил, що виникають при поляризації молекул та освіті диполів. ОткритиЯ. Д. ван дер Ваальса в 1869 році.
Ван-дер-ваальсово сили міжатомної взаємодії ін ?? ертних газів обумовлюють можливість існування агрегатних станів ін ?? ертних газів (газ, рідина тверді тіла).
До ван дер Ваальсових силам відносяться взаємодії між диполями (постійними і індукованими). Назва пов'язана з тим фактом, що ці сили є причиною поправки на внутрішній тиск в рівнянні стану реального газу Ван-дер-Ваальса. Ці взаємодії, а також водневі зв'язку, визначають формування просторової структури біологічних макромолекул.
Ван-дер-ваальсові сили також виникають між часткою (макроскопічної часткою або наночасткою) і молекулою і між двома частинками
15. Метод валентних зв'язків. Уявлення про гібридизації атомних орбіталей. Геометрія багатоатомних молекул: модель Гіллеспі.
Метод валентних зв'язків (МВС) інакше називають теорією локалізованих електронних пар, оскільки в базі методу лежить припущення, що хімічний зв'язок між двома атомами здійснюється за допомогою однієї або декількох електронних пар, які локалізовані переважно між ними. На відміну від ММО, в якому найпростіша хімічна зв'язок повинна бути як дво-, так і многоцентровой, в МВС вона вс ?? егда двухелектронная і обов'язково двухцентровие. Число елементарних хімічних зв'язків, які здатний утворювати атом або іон, так само його валентності. Так само, як і в ММО, в утворенні хімічного зв'язку беруть участь валентні електрони. Хвильова функція, що описує стан електронів, що утворюють зв'язок, прийнято називати локалізованої орбиталью (ЛО).
Відзначимо, що електрони, описувані ЛО, відповідно до принципу Паулі повинні мати протилежно спрямовані спини, тобто в МВС нд ?? е спини спарені, і вс ?? е молекули повинні бути діамагнітни. Отже, МВС принципово не може пояснити магнітні властивості молекул.
Проте, принцип локалізованих зв'язків має ряд важливих переваг, одне з яких - його надзвичайна наочність. МВС досить добре, наприклад, передбачає валентні можливості атомів і геометрію утворюється молекули. Остання обставина пов'язана з так званої гибридизацией АТ. Вона була введена для пояснення того факта͵ що двухелектронних двухцентровие хімічні зв'язки, утворені за рахунок АТ в різних енергетичних станах, мають однакову енергію. Так, Be * (2s 1 1p 1), B * (2s 1 2p 2), C * (2s 1 2p 3) утворюють за рахунок s - і p орбіталей відповідно дві, три і чотири зв'язку, а тому одна з них повинна бути міцніше інших. При цьому досвід показує, що в BeH2. BCl3. CH4 нд ?? е зв'язку рівноцінні. У BeH2 кут зв'язку дорівнює 180 °, у BCl3 - 120 °, а у CH4 - 109 ° 28 '.
Згідно з поданням про гібридизації, хімічні зв'язки утворюються змішаними - гібридними орбиталями (ГО), які вдають із себялін ?? ейную комбінацію АТ даного атома (s - і p-АТ Be, B, C), мають однакові енергією і формою, определ ?? енной орієнтацією в просторі (симетрією). Так s - і p орбіталі дають двеsp -го, розташовані під кутом 180 ° один щодо одного.
Гібридні орбіталі і геометрія молекул
Модель Гіллеспі ґрунтується на припущенні про те, що зв'язок здійснюється за рахунок пари електронів, а геометричну будову молекул / іонів визначається загальним числом електронних пар, що оточують центральний атом. При цьому виконуються наступні правила:
· Електронні пари, поділитися ?? енние і неподел ?? енние, розташовуються навколо центрального атома так, щоб їх відштовхування було мінімальним, ᴛ.ᴇ. на максимально віддаленій відстані один від одного
· Неподел ?? енная електронна пара займає більший обсяг, ніж поділитися ?? енная
· Обсяг займаної сполучною електронної пари тим менше, ніж ьольше електронний торгівельний атома, пов'язаного з центральним
· Дві електронні пари з подвійним зв'язком займають більший обсяг, ніж одна пара одинарного зв'язку
Недоліки моделі Гіллеспі
· Незастосування до більшості з'єдн ?? ень d-, s-елементів
· Незастосування до з'єдн ?? еніям з значної частки ионности зв'язку
· Неможливість передбачити геометрію молекул / іонів з ін ?? ертной неподел ?? енной електронної парою
16. Метод молекулярних орбіталей. Основні поняття. Двухцентровие двухелектронних молекулярні орбіталі. Енергетичні діаграми двоатомних гомоядерних молекул, утворених елементами 1-го і 2-го періодів. Магнітні властивості. Кореляції між порядком зв'язку і енергією іонізації. Енергетичні діаграми найпростіших гетероядерних молекул (CO, HF, LiH, H2 O).
У методі МО припускають, що в молекулі, як і в атомі, можна побудувати набір дозволених дискретних енергетичних рівнів і відповідних їм хвильових функцій (молекулярних орбіталей), що описують поведінку електрона в молекулі. На кожному енергетичному рівні може розташовуватися не більше двох електронів. Для побудови хвильових функцій МО часто використовують атомні орбіталі (АТ), описуючи кожну МО yi як лин ?? ейную комбінацію АТ (МО ЛКАО).
Вибір такого уявлення МО фізично досить зрозумілий: поблизу кожного ядра в молекулі поведінку електрона має бути схожим на його поведінку в атомі і описуватися відповідними даному атому АТ. При цьому наближене рішення (так як для молекул рівняння Шредінгера має бути вирішено тільки наближено!) Хоча б в цих областях буде досить коректним. В області між ядрами МО буде описуватися суперпозицией АТ. Завдання знаходження хвильових функцій МО при цьому зводиться до знаходження коефіцієнтів. Разом з тим, для кожної МО вкрай важливо визначити відповідну їй енергію.
17. Молекула водню і методи її опису. Метод валентних зв'язків і метод молекулярних орбіталей. Наближення ЛКАО. Перекриття атомних орбіталей, сигма і пі зв'язку, порядок (кратність) зв'язку. Хімічна зв'язок в частинках H2. H2 - і H2 + з позиції методів МО і ВС.
18. Хімічний зв'язок в гомоядерних двоатомних молекулах елементів другого періоду з позиції методів МО і ВС. Схеми МО для молекул початку і кінця другого періоду. Зміна порядку зв'язку, енергія зв'язку, довжини зв'язку при переході від Li2 до Ne2. Особливості молекул B2 і O2. Міцність зв'язку в молекулі N2
19. гетероядерні двоатомних молекули елементів другого періоду. Схеми МО для HF, CO, CN, OF. Метод ВС і гібридизації орбіталей. Валентний стан атома. Типи гібридизації і просторова будова молекул по Гіллеспі.
20. Ковалентний зв'язок у багатоатомних молекулах. Донорно-акцепторна взаємодія. Локалізована і делокалізованних зв'язок. Трехцентровие зв'язку. Спрямованість і насичуваності хімічної ковалентного зв'язку. Теорія відштовхування електронних пар валентної оболонки і просторова структура молекул
Донорно-акцепторна взаємодія - перенесення заряду між молекулами донора і акцептора без освіти між ними хімічного зв'язку (обмінний механізм); або передача неподел ?? енной електронної пари від донора до акцептора, що приводить до утворення зв'язку (донорно-акцепторні механізм).
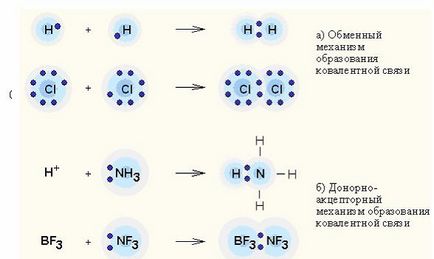
Ковалентний зв'язок - найбільш загальний вигляд хімічного зв'язку, що виникає за рахунок усуспільнення електронної пари за допомогою обмінного механізму. коли кожен з взаємодіючих атомів поставляє по одному електрону, або по донорно-акцепторного механізму. в разі якщо електронна пара передається в загальне користування одним атомом (донором) іншому атому (акцептору).
Делокалізованних зв'язок - зв'язок, електронна пара якої розосереджена між декількома (більше 2) ядр ами атомів (подобу металевої зв'язку).
Ковалентний зв'язок повинна бути локалізованої і делокалізованной. Локалізованої називають зв'язок, електрони якої фактично поділена ?? єни між двома ядрами пов'язують атомів. У разі якщо електрони зв'язку поділитися ?? єни більш ніж між двома ядрами, то говорять про делокалізованной зв'язку.
Делокалізованних зв'язок - це ковалентний зв'язок, молекулярна орбіталь якої охоплює більше двох атомів.
Делокалізованних зв'язку в більшості випадків є π-зв'язками. Οʜᴎ характерні для пов'язаних систем. У цих систе- мах здійснюється особливий вид взаємного впливу атомів - сполучення.
Сполучення (Мезомерія, від грец. Mesos - середній) - це вирівнювання зв'язків і зарядів в реальному молекулі (частці) в порівнянні з ідеальною, але не існуючою структурою.
Беруть участь в сполученні делокалізованних р-орбіталі можуть належати або двом π-зв'язків і більш, або π-зв'язку і одного атома з р-орбиталью. Відповідно до цього розрізняють π, π-спряження і # 961;, π-спряження. Система сполучення повинна бути відкритою або замкнутою і містити не тільки атоми вуглецю, а й гетероатоми.
Двухелектронная трёхцентровая зв'язок - одна з можливих електронно-дефіцитних зв'язків. Характерна тим, що пара валентних електронів локалізована в просторі відразу трьох атомів (звідси і поняття''електроно-дефіцітності'' -''нормальним'' випадком є двухелектронная двухцентровие зв'язок). Загальний опис механізму утворення електронодефіцітних зв'язків дається в рамках теорії молекулярних орбіталей (модель''несвязивающіх'' орбіталей).
Найбільший внесок в розвиток теорії трёхцентрових двухелектронних зв'язків був зроблений при вивченні бороводородов і борорганіческіх з'єдн ?? ень, де подібне зв'язування реалізується дуже часто (наприклад, в діборане).
Можливі й інші електронодефіцітние зв'язку, з іншим співвідношенням валентних електронів і пов'язаних атомів. Подібне зв'язування часто реалізується в металлорганических з'єдн ?? еніях.
Теорія відштовхування електронних пар валентних орбіталей (ОЕПВО) - один з підходів в хімії, необхідний для пояснення і передбачення геометріімолекул. Відповідно до цієї теорії молекула нд ?? егда буде приймати форму, при якій відштовхування зовнішніх електронних пар мінімально (принцип мінімуму енергії).
Характерні властивості ковалентного зв'язку - спрямованість, насичуваність, полярність, поляризованість - визначають хімічні і фізичні властивості з'єдн ?? ень.
Спрямованість зв'язку обумовлена молекулярною будовою речовини і геометричної форми їх молекули. Кути між двома зв'язками називають валентними.
Насичуваність - здатність атомів утворювати обмежене число ковалентних зв'язків. Кількість зв'язків, утворених атомом, обмежено числом його зовнішніх атомних орбіталей.
Полярність зв'язку обумовлена нерівномірним распредел ?? еніем електронної щільності внаслідок відмінностей в електронний торгівельний атомів. За цією ознакою ковалентні зв'язки підрозділяються на неполярні і полярні (неполярні - двухатомная молекула складається з однакових атомів (H2. Cl2. N2) і електронні хмари кожного атома розподіляються симетрично щодо цих атомів; полярні - двухатомная молекула складається з атомів різних хімічних елементів, і загальне електронне хмара зміщується в бік одного з атомів, утворюючи тим самим асиметрію распредел ?? ення електричного заряду в молекулі, породжуючи дипольний момент молекули).
Поляризуемость зв'язку виражається в зміщенні електронів зв'язку під впливом зовнішнього електричного поля, в т.ч. і інший реагує частки. Поляризуемость визначається рухливістю електронів. Полярність і поляризованість ковалентних зв'язків визначає реакційну здатність молекул по відношенню до полярних реагентів.
21. Хімічний зв'язок і типи кристалів. Типи кристалічних решіток. Основи зонної теорії. Зв'язок в металах, напівпровідниках і діелектриках. Дефекти кристалічної решітки. Тверді розчини. Іонна зв'язок. Взаємодія іонів в кристалічній решітці. Енергія іонної кристалічної решітки, вплив розмірів і зарядів іонів
Зонна теорія - опис руху електронів в кристалах, є основою сучасної теорії металів, напівпровідників і діелектриків.
Величина забороненої зони є ключовою величиною і визначає електричні і оптичні властивості матеріалу.
Провідники - матеріали, з яких зона провідності і валентна зона перекривання утворюють одну зону - зону провідності (таким чином електрон може вільно переміщатися між ними).
Діелектрики - матеріали, з яких зона не перекривається. Для того, щоб перевести електрон з валентної зони в зону провідності, потрібна значна енергія, в зв'язку з цим діелектрики майже не проводять струм.
Напівпровідники - матеріали, з яких зони не перекриваються. Для того, щоб перевести електрон з валентної зони в зону провідності, потрібна енергія менша, ніж для діелектрика, в зв'язку з цим чисті напівпровідники слабо пропускають струм.
· Молекулярна - у вузлах молекулярної решітки знаходиться молекули, це решітка властива з'єдн ?? ення з ковалентним зв'язком. сюди відносять не метали, (виключення H, Si)? нд ?? е органічні з'єдн ?? ення H2SO4? HCl
· Атомні - в вузлах знаходяться атоми алмаз, графіт - не розчиняється у воді тугоплавкі. взагалі не розчинні
· Іонна - у вузлах розташовуються позитивні, негативні іони, які пов'язані один з одним іонами електричним тяжінням солі. підстави, луги. Міцність, висока температура плавлення. НЕ летючі. багато розчиняються у воді
· Металева - в вузлах розташовані атоми металу, теплопровідність
Читайте також
Кулонівські сили тяжіння, що виникають при взаємодії заряджених іонів, сильні і діють однаково в усіх напрямках. В результаті цього розташування іонів упорядковується в просторі певним чином, утворюючи іонну кристалічну решітку. [Читати далі].