Що таке регенерація
Вчені давно намагаються зрозуміти, яким чином земноводні - наприклад, тритони і саламандри - регенерують відірвані хвости, кінцівки, щелепи. Більш того, у них відновлюються і пошкоджене серце, і очні тканини, і спинний мозок.
Спосіб, який застосовується земноводними для саморемонта, став зрозумілий, коли вчені порівняли регенерацію зрілих особин і ембріонів. Виявляється, на ранніх стадіях розвитку клітини майбутнього істоти незрілі, їх доля цілком може змінитися.
Це показали експерименти над ембріонами жаб. Коли ембріон має всього лише кількох сотень клітин, з нього можна вирізати частину тканини, якої уготована доля стати шкурою, і помістити її в область мозку.
І ця тканина стане частиною мозку. Якщо ж подібна операція проводиться з більш зрілим ембріоном, то з клітин шкіри все одно розвивається шкіра - прямо посеред мозку. Тому що доля цих клітин вже визначена.
Для більшості організмів клітинна спеціалізація, через яку одна клітина стає кліткою імунної системи, а інша, скажімо, частиною шкурки - це дорога з одностороннім рухом, і клітини дотримуються своєї "спеціалізації" до самої смерті.
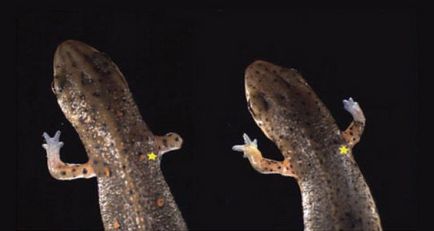
А клітини земноводних вміють повернути час назад і повернутися до того
моменту, коли призначення могло змінитися. І якщо тритон або
саламандра втратили лапу, на пошкодженій ділянці тіла клітини кісток, шкіри і крові стають клітинами без характерних ознак. Вся ця маса вдруге "новонароджених" клітин (її називають бластеми) починає посилено ділитися. І відповідно до потреб "поточного моменту" ставати клітинами кісток, шкіри, крові. Щоб стати в кінці нової лапою. Краща за попередню.
А як у людини?
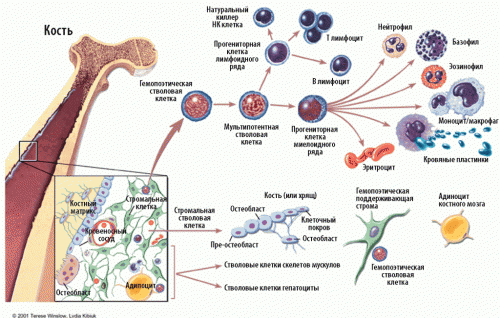
Відомо тільки два види клітин, які можуть регенерувати, - це
клітини крові і клітини печінки. Але тут принцип регенерації інший. коли
ембріон ссавця розвивається, трошки клітин залишається в стороні від процесу спеціалізації.
Це - стовбурові клітини. Вони мають здатність поповнювати запаси крові або відмерлих клітин печінки. Кістковий мозок теж містить стовбурові клітини, які можуть ставати м'язову тканину, жиром, кістками або хрящами - в залежності від того, які поживні речовини їм даються. Принаймні в кюветах.
Якщо ввести клітини кісткового мозку в кров миші з пошкодженими м'язами, ці клітини збираються в місці пошкодження і виправляють його. Втім, що вірно для миші, не застосовується до людини. На жаль, м'язові тканини дорослої людини не відновлюються.
Доктор Хебер-Катц вважає, що організми спочатку мали два
методу лікування від ран - імунну систему і регенерацію. Але в ході еволюції обидві системи стали несумісні один з одним - і довелося вибирати. Хоча регенерація може на перший погляд здатися кращим вибором, Т-клітини для нас - нагальною. Адже вони - основна зброя організму проти пухлин. Що толку бути здатним відрощувати собі заново втрачену руку, якщо одночасно в організмі будуть бурхливо розвиватися ракові клітини?
Виходить, що імунна система, захищаючи нас від інфекцій і раку, одночасно пригнічує нашу здатність до "саморемонту".
На яку клітину натиснути
Інструкція з вирощування нових органів записана в ДНК
кожної з наших клітин, нам просто потрібно змусити їх "включити" свою
здатність, а далі процес сам подбає про себе.
Фахівці Ontogeny працюють над створенням засобів, що включають
регенерацію. Перше - вже готове і, можливо, скоро буде дозволено до
продажу в Європі, США і Австралії. Це - фактор росту під назвою
OP1 або BMP7. він стимулює зростання нової кісткової тканини. OP1 допоможе при лікуванні складних переломів, коли дві частини зламаної кістки сильно не збігаються один з одним і тому не можуть зростися. Часто в таких випадках кінцівку ампутують. Але OP1 стимулює кісткову тканину так, що вона починає рости і заповнює собою проміжок між частинами зламаної кістки.
Все, що потрібно зробити лікарям, - це подати сигнал, щоб кісткові
клітини "росли", а тіло саме знає, скільки потрібно кісткової тканини і де.
Якщо такі сигнали росту знайти для всіх типів клітин, відростити нову
ногу можна буде за допомогою декількох ін'єкцій.
Але істотний бар'єр: стимулювання клітин до регенерації може привести до виникнення раку. Земноводні, які не мають імунного захисту, як-то інакше захищені від раку - замість пухлин у них виростають нові частини тіла.
Але клітини ссавців так легко піддаються безконтрольного обвального поділу.
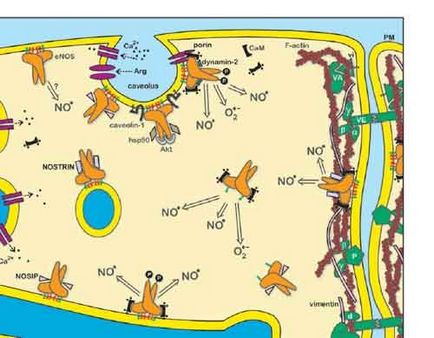
Отже, основними цілями досліджень з старіння є розвиток стратегій по заміщенню старіючих органів чи клітин, заснованих на інструментах надання безсмертя, стовбурових клітинах або штучних заступників.
Нещодавно, однак, нова концепція функціонального відновлення було запропоновано на основі функціонального відновлення чутливості старіючих клітин до низки агонистов, включаючи чинники зростання.
Було показано, що старіючі фенотип гипореактивности і морфологічних змін добре відновлюються шляхом модуляції кількох мембрано - пов'язаних молекул, званих воротарями, серед яких кавеолін є однією з основних детермінант.
Кавеолін є найважливішим компонентом кавеоли, відповідальним за регуляцію сигнальною трансдукції, ендоцитоз і трансцитозу і перебудову цитоскелету через його підтримує домен. Статус кавеолина строго пов'язаний з клітинної трансформацією при його виснаженні і зі старіючим фенотипом при оверекспрессіі. Тому, просте зниження статусу кавеолина в старіючих клітинах веде до відновлення чутливості до мітогенний стимулам і навіть до відновлення форми клітин.
Ці дані є сильним підтвердженням погляду, що молекули - воротарі, представлені кавеоліном, можуть грати головну роль у визначенні старіючих фенотипів. Виходячи з цих результатів може бути виведено, що принцип заміщення
не обов'язково повинен бути основним, але принцип відновлення може його замінити для корекції стану старіючих клітин і організмів.
Таким чином, нова концепція функціонального відновлення було запропоновано на основі відновлення чутливості старіючих клітин до низки агонистов, включаючи чинники зростання.
Старіння клітин є подією, яка відбувається у всіх нормальних клітинах. Клітини, які ростуть у культурі, мають обмежену тривалість життя і не ростуть після певного числа поділів. Вони припиняють ділитися і врешті-решт вмирають. Відповідно до цього очікувана тривалість життя в
встановленої культурі клітин залежить від віку донора.
Клітини, що придбали безсмертя, через кризовий перод трансформації за рахунок впливу хімічних
речовин або вірусів, точно так же, як лінії злоякісних клітин в цілому, мають здатність ділитися невизначено довго.
Інша форма клітинної смерті, апоптоз, або програмована клітинна смерть, відбувається в багатьох фізіологічних ситуаціях, наприклад, при диференціюванні кератиноцитів.
Наука про старінні клітин називається цітогеронтологія. Тривалість життя нормальних диплоїдних клітин в культурі обмежена, перебуває під генетичним контролем і її можна модифікувати (гомонами, факторами росту і ін.).
Більшість клітин ссавців при приміщенні в культуру зазнають обмежене число клітинних поділів перед тим, як переходять в нечувствительное непроліферірующей стан, зване старінням.
Однак, кілька шляхів, які активуються поодинці або спільно можуть допомогти клітинам обійти старіння по крайней мере на обмежені періоди часу. вони включають
теломеразной шлях, що потребується для підтримки теломерна решт, і шляхи p53 і Rb, що вимагаються для направлення старіння у відповідь на пошкодження ДНК, скорочення теломерів і мітогеном сигнали, і шлях подібного інсуліну ростового фактора, який може регулювати тривалість життя і клітинну проліферацію.
Ембріональні стовбурові клітини безсмертні, бо ці шляхи в них строго регулюються.
Таким чином, клітини, що ростуть в культурі, мають обмежену
тривалість життя і не ростуть після певного числа поділів.
Тривалість життя нормальних диплоїдних клітин в культурі перебуває під генетичним контролем і її можна модифікувати (гомонами, факторами росту і
ін.).
Cтволовие клітини і старіння
Дослідження по виявленню генів, що регулюють стовбурові клітини, зазвичай приймають одну з двох різних ліній дослідження.
Прямий генетичний підхід розпочинає переговори з вимірних фенотипических відмінностей до генетичному поліморфізму і, як припускає ім'я, шлях дослідження має зворотний порядок при використанні
зворотної генетики. Число нововідкритих локусів, відповідальних за
специфічні для стовбурових клітин фенотип і функціонування збільшується з великою швидкістю внаслідок успіху обох підходів. Ці локуси регулюють стовбурові клітини внутрішніми (клітинно-автономними) і / або зовнішніми механізмами і диктують долю стовбурових клітин.
Протягом процесу старіння стовбурові клітини зазнають як кількісні, так і якісні зміни, які, як
припускають, впливають як на швидкість старіння, так і на тривалість життя організму.
На самих ранніх стадіях ембріонального розвитку клітини мають здатність необмежено ділитися і потім диференціюватися в різні типи клітин тіла.
Недавні дослідження виявили, що велика частина чудового регенераторного потенціалу ембріональних стовбурових клітин зберігається невеликий популяцією клітин в більшості тканин дорослого організму.
Міжклітинні сигнали, які контролюють проліферацію, диференціювання і виживання стовбурових клітин були
ідентифіковані і включені в набір різних чинників зростання, цитокінів і молекул клітинної адгезії.
Внутрішньоклітинні механізми, які визначають долю стовбурових клітин також були виявлені і включають встановлені шляху вторинних
месенджерів, нові транскрипційні фактори і теломерази.
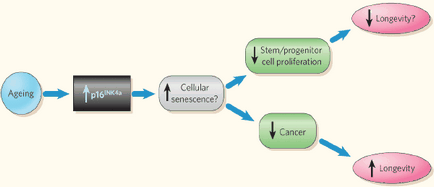
Чудова пластичність стовбурових клітин змушує припустити, що ендогенні або трансплантовані стовбурові клітини можуть бути можуть бути використані в шляхах, які дозволять їм відшкодовувати втрату дисфункциональной клітинної популяції при хворобах від нейродегенеративних і гематопоетичних
розладів до діабету і серцево-судинної хвороби.
Роль стовбурових клітин в багатоярусної організації структури тканини збільшує потенціал довгожительства в багатоклітинних організмі. Ця роль буде нести відповідальність за механізм еволюції самих стовбурових клітин.
Успішний розвиток тканинних терапій і управління ними повинно проводитися з урахуванням принципів роботи цього механізму.
Метою цього огляду є, по-перше, критично розглянути, що відомо про вплив старіння на стовбурові клітини в цілому і на гематопоетичні клітини зокрема.
По-друге, наведені дані в підтримку гіпотези, що
старіння стовбурових клітин відіграє критичну роль у визначенні ефектів старіння на функцію органів, і в кінці кінців на тривалість життя ссавців.
Старіння надає кількісне і якісне вплив на
стовбурові клітини. В цілому якісні зміни важливіші, оскільки вони впливають на потенціал самооновлення, потенціал розвитку і взаємодія з зовнішніми сигналами, включаючи сигнали від строми.
Хоча гематопоезу зазвичай підтримується на нормальному і які підтримують життя рівнях протягом нормального старіння, знижена функція стає очевидною, коли стовбурові
клітини піддаються стресу. Існує достатньо даних про зменшення здатності до самооновлення, обмеження широти здатність до розвитку і зменшенні числа потомства у старих стовбурових клітин, які зазнали гематопоетичних вимогам. Зроблено прогноз, що пластичність в потенціалі розвитку, якою володіють молоді стовбурові клітини, втрачається в ході
старіння. Ті частини світу, де ростуть стандарти життя, там також зростає частка людей похилого в населенні.
Вплив старіння на багато фізіологічні функції не є добре вивченим і оціненим. Суспільна необхідність забезпечити поліпшення якості життя для цього зростаючого сегмента популяції потребує більшої уваги до особливостей старіння в експериментальних дослідженнях.
Дослідження популяцій стовбурових клітин ймовірно будуть плідними дослідженнями такого типу.
Стовбурові клітини визначаються по їх великий здатності до самообновлнію, але тим не менш є безліч свідчень зниження функціонування стовбурових клітин під час старіння.
У той час як внутрішньоклітинний відновлення та захисні механізми визначають тривалість життя окремих клітин,
існують аргументи, що соматичні стовбурові клітини визначають
тривалість життя всієї тканини, і тому грають ключову роль в процесі старіння організму.
Нещодавно було показано, що потенціал розвитку соматичних
стовбурових клітин може бути набагато більше, ніж вважалося раніше. Хоча механізми, що регулюють пластичність стовбурових клітин далекі від ясності, варто обговорити потенційну значимість цих відкриттів для пізнання процесу старіння. Хороший огляд по цій темі можна знайти тут.
Таким чином, протягом процесу старіння стовбурові клітини зазнають як кількісні, так і якісні зміни, які, як припускають, впливають як на швидкість старіння, так і на тривалість життя організму.
В цілому якісні зміни важливіші, оскільки вони впливають на потенціал самооновлення, потенціал розвитку і взаємодія з зовнішніми сигналами.
Велика частина чудового регенераторного потенціалу ембріональних стовбурових клітин зберігається невеликий популяцією клітин в більшості тканин дорослого організму. Міжклітинні сигнали, які контролюють проліферацію,
диференціювання і виживання стовбурових клітин були ідентифіковані (чинників зростання, цитокінів і молекул клітинної адгезії).
Внутрішньоклітинні механізми, які визначають долю стовбурових клітин також були виявлені і включають
встановлені шляхи вторинних месенджерів, нові транскрипційні фактори і теломерази.
Старіння стовбурових клітин відіграє критичну роль у визначенні ефектів старіння на функцію органів, і в кінці кінців на тривалість життя ссавців.
В цілому якісні зміни важливіші, оскільки вони
впливають на потенціал самооновлення, потенціал розвитку і взаємодія з зовнішніми сигналами.