проста зв'язок
Найпростіше органічна сполука - метан. Його молекула складається з п'яти атомів - одного атома вуглецю і чотирьох атомів водню, рівномірно розподілених в просторі навколо цього центрального атома вуглецю. Тут ми стикаємося насамперед з найважливішим постулатом органічної хімії - у всіх незаряджених органічних молекулах вуглець завжди чотиривалентний. Графічно це виражається в тому, що він повинен бути з'єднаний з хімічними символами інших елементів або того ж вуглецю чотирма рисками. У метані всі чотири атома водню знаходяться на однаковій відстані від атома вуглецю і максимально віддалені один від одного в просторі.
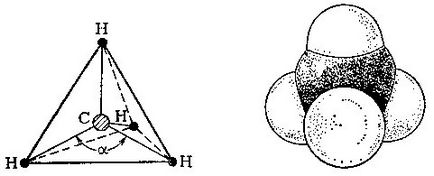
У молекулі метану атом вуглецю знаходиться в центрі правильного тетраедра, а чотири атома водню - по його вершин.
Так виглядає молекула метану з урахуванням розмірів атомів.
Щоб побудувати модель молекули, візьмемо тетраедр, т. Е. Правильний чотиригранник, складений з рівносторонніх трикутників, і помістимо в його центр атом вуглецю. Атоми водню розташуються по вершинах тетраедра. З'єднаємо всі водень з центральним атомом вуглецю. кут # 945; між двома такими лініями складе 109 градусів і 28 хвилин.
Отже, ми побудували модель метану. Але які розміри молекул в дійсності? В останні десятиліття за допомогою фізичних методів дослідження (про них мова попереду) вдається точно визначити міжатомні відстані в молекулах органічних сполук. У молекулі метану відстань між центрами атома вуглецю і будь-якого водневого атома одно 0,109 нм (1 нанометр, нм, дорівнює 10 -9 м). Щоб уявити наочно, як виглядає молекула в просторі, користуються моделями Стюарта - Бріглеба, в яких атоми зображуються кульками певного радіуса.
Тепер задамося таким питанням: які сили пов'язують атоми в молекулі органічної сполуки, чому атоми водню не відривати від вуглецевого центру?
Атом вуглецю складається з позитивно зарядженого ядра (його заряд дорівнює +6) і шести електронів, що займають різні орбіталі * навколо ядра, кожній з яких відповідає певний рівень енергії.
* (Орбиталь можна розглядати як область простору, в якій найбільш велика ймовірність зустріти електрон)
Два електрона займають найнижчу, найближчу до ядру орбиталь. Вони всього сильніше взаємодіють зі "своїм" ядром і участі в утворенні хімічних зв'язків не беруть. Інша річ - інші чотири електрона. Вважають, що в так званому збудженому атомі вуглецю, т. Е. В окремому атомі, які не утворює ніяких зв'язків з іншими атомами, ці електрони розташовуються в такий спосіб: два на нижньому підрівні s і два на більш високому підрівні р. Дещо спрощено і схематично можна вважати, що хмара, яке утворює електрон, що знаходиться на s -подуровне, має форму сфери. Хмари р-електронів виглядають об'ємними вісімками, причому ці вісімки можуть бути розташовані в просторі уздовж осей х, y і z. Відповідно до цього в кожному атомі є три р орбіталі: px. рy і pz. Отже, кожна орбіталь в атомі має певну форму і особливим чином розташована в просторі.
Для того щоб вступити у взаємодію з іншими атомами, утворити з ними хімічні зв'язки, атом вуглецю повинен перш за все перейти в особливу, збуджений стан. При цьому один електрон перескакує з s орбіталі на p орбіталь. В результаті один електрон займає сферичну s орбіталь, а три інших електрона утворюють три орбіталі-вісімки. Однак такий стан атому енергетично невигідно. Нижчою енергії атома відповідають чотири однакові орбіталі, симетрично розташовані в просторі. Тому відбувається змішування, усереднення, або, як кажуть, гібридизація наявних орбіталей. і в результаті виходять чотири нові однакові орбіталі.
Ці орбіталі-гібриди також схожі на вісімки, але вісімки однобокі: електронна щільність майже повністю зміщена в одну сторону. Такі гібрідізоваться орбіталі позначаються sp 3 (по числу електронів з різних НЕ гібридних орбіталей, що беруть участь в їх утворенні: один з s орбіталі і три - з р орбіталі).
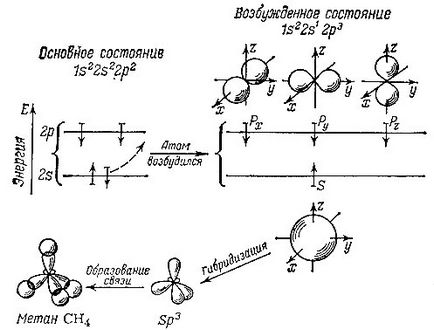
Тут схематично показана гібридизація орбіталей при утворенні молекули метану. Стрілками показано відносне напрямок спінів електронів
Як же влаштована молекула метану? До кожної з чотирьох гібридних орбіталей, спрямованих від атома вуглецю в різні боки (а точніше, в кути уявного тетраедра, який можна побудувати навколо нього), підходять атоми водню Н. Атом водорода- це ядро із зарядом +1 (для легкого ізотопу звичайного водню - просто протон), і один електрон, що займає сферичну орбиталь навколо протона. Хмари "вуглецевих" і "водневих" електронів перекриваються, а це й означає утворення хімічного зв'язку. Чим сильніше перекриваються хмари електронів різних атомів, тим міцніше зв'язок. Тепер стає зрозумілим, чому гібрідізоваться орбіталі вигідніше - адже така однобока, випнута в одну сторону вісімка може набагато сильніше перекриватися з хмарою водневого електрона, ніж менш протяжні в просторі не гібридні орбіталі. Відзначимо, що ці міркування носять дещо умовний характер: чистий, так би мовити, одиночний і збудженому атом вуглецю не існує реально. Тому немає сенсу обговорювати, як же насправді відбуваються всі ці трансформації орбіталей, звані гибридизацией. Однак для зручності опису хімічних зв'язків за допомогою формул і чисел такі умовності виявляються корисними. Ми в цьому ще не раз переконаємося.
Як отримати метан?
Один з найпростіших шляхів - подіяти водою на карбід алюмінію:
Однак карбід алюмінію - занадто дороге вихідна речовина для отримання такого звичайного, такого дешевого продукту, як метан, і отримувати його з інших з'єднань немає потреби - адже природний газ на 85-98% складається з метану.
Метан - один з основних "цеглинок", з яких можна будувати органічні сполуки. Які ж це з'єднання і як їх отримати з метану?
Взагалі-то метан - речовина порівняно інертне, і набір хімічних реакцій, які можна з ним провести, невеликий.
Візьмемо суміш двох газів - метану і хлору і помістимо її в скляну посудину. Якщо цю посудину тримати в темряві, то ніякої реакції не спостерігається. Але спробуємо висвітлити склянку сонячним світлом.
Квант світла взаємодіє з молекулою хлору, в результаті молекула розщеплюється на дві частини - два атома хлору:
Утворені атоми набагато активніше молекул, вони тут же атакують молекули метану і захоплюють атоми водню. При цьому утворюються молекули хлористого водню НСl і вельми нестійкі, дуже активні частинки, так звані метальних радикали # 8901; СН3.
Метальних радикал далі "розщеплює" молекулу хлору:
В результаті виходить вже відомий нам атом хлору (його подальшу долю неважко передбачити: він атакує нові молекули метану, і все повторюється) і хлорметан, або метилхлорид, - похідне метану, в якому один з атомів водню замінений на хлор.
Реакція, про яку ми розповіли, належить до розряду так званих ланцюгових реакцій. в яких кожна стадія, як в ланцюзі, пов'язана з попередньою і з подальшою. Активні частинки - продукт однієї стадії (тут це атоми хлору і метальних радикали # 8901; СН3) -використовуються в наступній стадії як вихідні речовини. Відкриття ланцюгових реакцій було одним з великих подій в історії хімічної науки, а академік Н. Н. Семенов і англійський вчений С. Н. Хіішельвуд за внесок у вивчення таких реакцій і створення їх теорії були удостоєні Нобелівської премії.
Якщо в реакцію вводити такі кількості реагентів, щоб на одну молекулу хлору доводилося дві молекули метану, то в основному ми отримаємо хлористий метил СН 3 Сl. Якщо ж взяти хлор в надлишку, то реакція заміщення піде далі і вийде, крім хлористого метилу, ще хлористий метилен СН2 Сl2. хлороформ СНСl3 і, нарешті, продукт повного заміщення водню на хлор, чотирихлористий вуглець ССl4.
Але не будемо забувати про нашого завдання: побудувати різні складні молекули з простих цеглинок-молекул метану. Для цього нам знадобиться метилхлорид. Якщо подіяти на це з'єднання металевим натрієм, то з кожних двох молекул СН3 Сl утворюється одна молекула етану, в якій є зв'язок вуглець - вуглець:
Що таке етан? Це метан, в якому один з відрядив замінений на радикал метил # 8901; СН3. А сам цей радикал, як ми вже знаємо, виходить при відриві від метану одного водневого атома.
Якщо тепер в етан замістити один з відрядив (будь-який атом) на метил, то ми отримаємо нову речовину - пропан СН3 -СН2 -СН3. Як це можна зробити практично, ми знаємо: спочатку в метані і етан замістити один водень на хлор і потім подіяти на суміш метил-і Етілхлорід натрієм (ця реакція називається реакцією Вюрца в честь французького хіміка, її відкрив):
Підемо далі. Замести в пропане один з атомів водню на хлор. Виявляється, тепер вже не все одно, який атом заміщати! Заміщаючи водень при крайньому атомі вуглецю (таких атомів два) або ж при середньому, ми отримаємо два різних сполуки: нормальний пропілхлорід (н -пропілхлорід) і ізопропілхлорід:
Замінимо тепер в кожному з цих сполук атоми хлору на метальних групи. Ми отримаємо два різних бутану - нормальний (т. Е. Розгалужений) бутан (н -бутан) і з -бутан:
Приставив до отриманих молекулам ще по "цеглинці". Почнемо з н -бутан. Тут можна замістити на метил один з крайніх атомів водню. Отримаємо нормальний пентан. Можна замістити один з середніх відрядив. Прийдемо до з -пентану. Мабуть, з н -бутан більше нічого нового не отримаєш. Звернемося до з -бутану. Якщо в ньому замістити один з крайніх відрядив (в СН3-групи), то прийдемо до вже згадуваного з -пентану, а заміщаючи середній єдиний атом водню, отримаємо неопентана:
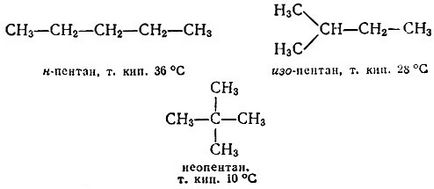
Продовжувати цю процедуру можна до нескінченності. Всі ці сполуки називаються вуглеводнями (точніше - граничними, насиченими вуглеводнями, або алканами), тому що вони складаються всього з двох елементів-вуглецю і водню. У будь-якому алканами число водневих атомів становить 2n + 2, де n - число вуглецевих атомів. Тому формулу граничного вуглеводню можна в загальному вигляді записати так: Сn Н2N + 2.
У побудові наших структур ми, треба сказати, вчасно зупинилися. Справа в тому, що кількість можливих ізомерів катастрофічно швидко зростає зі збільшенням числа вуглецевих атомів в молекулі алкана. Так, для декана, вуглеводню С10 Н22. можливо 75 різних ізомерів, число ізомерів для вуглеводню С20 Н42 (ейкозан) одно 366 319. Кількість же можливих ізомерів для тетраконтана, вуглеводню С40 н82. навіть важко собі уявити 62 491 178 805 831.
Тепер стає зрозуміло, чому вже сьогодні відомо таке величезне число органічних сполук - кілька мільйонів - і чому в цьому відношенні хімія органічна далеко обігнала хімію неорганічну. Але ж до цього часу говорилося тільки про найпростіші представників органічних речовин - про насичених вуглеводнях.
Ми виводили ряд ізомерних вуглеводнів з метану, користуючись реакцією Вюрца. Однак на практиці так ніхто не чинить. Справа в тому, що найпростіші вуглеводні поряд з метаном містяться в природному газі, склад якого різний для різних родовищ. Наприклад, в газі Північно-Ставропольського родовища міститься 85% метану, близько 5% етану, 2,5% пропану і 1,4% пентана і більш важких вуглеводнів. Газ Газлинское родовища складається з метану на 98%, етану в ньому лише 1,6%. Багато вуглеводнів в нафти, але про це - в наступних розділах.
Вуглеводні нижчі - метан, етан, пропан і бутан - безбарвні гази без запаху або зі слабким запахом бензину. Вуглеводні від пентану до пентадекана С15 Н32 - рідини і, нарешті, вищі вуглеводні при звичайній температурі - тверді речовини.
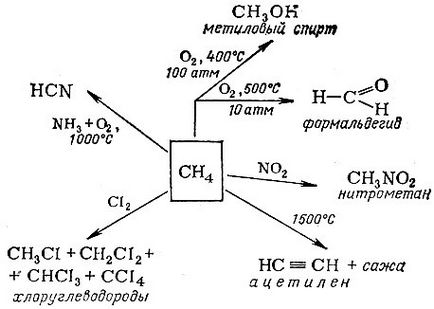
Деякі приклади використання метану
У міру збільшення числа атомів вуглецю зростає температура кипіння і плавлення сполуки.
У граничних вуглеводнів є інша назва - парафіни. що відображає їх хімічну інертність (по латині parum affinis - малу спорідненість). І все ж вони досить широко застосовуються в хімічній промисловості для отримання найрізноманітніших речовин. Основні напрямки промислового використання метану показані на схемі.
Перш ніж закінчити розмову про метан і граничних вуглеводнях, відповімо на одне питання: як здійснюється зв'язок в парафінах між двома атомами вуглецю, наприклад, в етан? Тут все просто - навколо кожного вуглецевого атома є, як і в метані, чотири гібрідізоваться sр 3 орбіталі, три з них здійснюють зв'язку з атомами водню, а одна перекривається точно з такою ж орбиталью іншого вуглецевого атома. Довжина зв'язку С-С становить 0,154 нм.