Основні фактори, що впливають иа критичну концентрацію міцелоутворення. Методи визначення ККМ
Критична концентрація міцелоутворення - найважливіша характеристика розчинів ПАР. Вона залежить насамперед від будови вуглеводневого радикала в молекулі ПАР і харак-тера полярної групи, наявності в розчині електролітів і не-електролітів, температури і інших чинників.
Довжина вуглеводневої радикала робить вирішальний вплив на процес міцелоутворення у водних середовищах. Як і ніженіе енергії Гіббса системи в результаті міцеллообразующие-вання тим більше, чим довше вуглеводнева ланцюг. Дослід-вання показують, що освіта предміцеллярних асоціації - тов спостерігається в поверхнево-активних електролітах з наявністю в вуглеводневого ланцюга більше чотирьох атомів углер-да. Однак в таких з'єднаннях слабо виражене відмінність між гідрофільній і гідрофобною частинами (висока зна-ня ГЛБ). У зв'язку з цим енергія асоціювання недостатня, щоб утримати молекули від безладного теплового руху-ня і тим самим створити умови для міцелоутворення. Як правило, здатність до міцелоутворення властива молекулам ПАР з довжиною вуглеводневого радикала більше 8-10 атомів вуглецю.
Рівняння, що встановлює зв'язок між ККМ «довжиною вуглеводневого радикала, може бути виведено з рассмотре-ня міцеллообразованія як процесу утворення нової фази. При рівновазі хімічні потенціали ПАР в розчині ЦР і в міцелі рівні ЦР = | д, м, і можна записати:
Вважаючи міцелу фазою чистого ПАР, можна прийняти era активність в міцелі що дорівнює одиниці. Тоді отримаємо:
Ліва частина рівняння (VI.52) являє собою енергію перенесення речовини з розчину в чистий стан, т. Е. Енергію розчинення. Відомо, що енергія розчинення органіч-ських сполук у воді зменшується лінійно зі збільшенням довжини вуглеводневого радикала. отже
/? ЛпККМ = а - Іоп (VI.53)
Де а - постійна, що характеризує енергію розчинення функціональних груп (полярних частин молекул); Ь - постійна, що характеризує енер-гію розчинення, що припадає на одну групу СН2; п - число груп СН2.
Для органічної середовища маємо:
RT In K. KM = a + 6rt (VI.54)
Т. е. При збільшенні довжини вуглеводневого радикала підвищує фізичну-ється розчинність ПАР і зростає ККМ. Розгалуженість, ненасиченість і циклизация вуглеводневої радикала умень-шают схильність до міцелоутворення і збільшують ККМ.
Характер полярної групи грає істотну роль при міцеллообразованія у водних і неводних середовищах. Її вплив па ККМ відображає параметр а в рівняннях (VI.53) і (VI.54). Роль гідрофільних груп у водних розчинах ПАР укладає-ся в тому, щоб утримувати утворюються асоціати в воді і регулювати їх розмір. Сферична форма іонних мицелл встановлюється, якщо енергія асоціювання вуглеводневих ланцюгів досить велика і перевищує енергію електростат-чеського відштовхування між іонними групами. Гідратація противоионов, що оточують міцели, сприяє відштовхуючись-нию, а менш гідратованих іони легше адсорбуються на поверхні міцел. У зв'язку з цим спостерігається зменшення ККМ і збільшення міцелярної маси для катіонних ПАР в ряду С1<В-<1- и анионных ПАВ в ряду Na+ Введення електролітів у водні розчини неіоногенних ПАР слабо впливає на ККМ і розмір міцели. Для йоногенних ПАР цей вплив істотно. Порівняння властивостей йоногенних і неіоногенних ПАР, що мають однакові вуглеводневі ланцюги, показує, що мицеллярная маса йоногенних ПАР на-багато менше, ніж для неіоногенних, причому з ростом кон-рації електроліту мицеллярная маса йоногенних ПАР зростає, а неіоногенних ПАР змінюється мало. вплив електролітів На ККМ описується загальним рівнянням (для - йоногенних: ПАР): Гдеа 'до У - постійні, що мають той же фізичний зміст, що і в рівнян-неніі (VI.53); K - константа; с - концентрація індиферентного електро-літа. За відсутності індиферентного електроліту з = ККМ, і рівняння (VI.55) переходить в (VI.53); при n = const напів-чає залежність ККМ тільки від концентрації електроліту. Введення неелектролітів (органічних розчинників) у водні розчини ПАР також призводить до зміни ККМ. При наявності солюбилизации стійкість міцел підвищується, т. Е. Зменшується ККМ. Якщо молекули розчинника не входить всередину міцел, то вони, як правило, збільшують ККМ або за рахунок підвищення розчинюючої здатності середовища, або в ре-док зменшення її діелектричної проникності і збіль-личен сили відштовхування між органічними іонами йоногенних ПАР. У той же час із зменшенням діелектричної-ської проникності розчинника знижується дисоціація ионо-генних ПАР, що збільшує здатність ПАР до утворення міцел. Для регулювання властивостей ПАР застосовують їх суміші, в яких виявляються синергетичні або антагоністичні ефекти, т. "Е. Такі суміші можуть мати значно вищу або менш високу міцеллообразующие, солюбілізі - рующую здібності та ін. Методи визначення ККМ засновані на реєстрації різкої зміни фізико-хімічних властивостей розчинів ПАР в зави-ності від концентрації (наприклад, поверхневого натяж-ня а, каламутності т, еквівалентній електропровідності К, осмо-тичного тиску я, показника преломленіяп). На кривій залежності властивість - склад в області ККМ зазвичай появля-ється злам (рис. VI.6). Одна з вет-вей кривих (при більш низьких кон-центрації) на рис. VI.6 описує властивості системи в молекулярному со-стоянні, а інша - в колоїдному. Абсциссу точки зламу умовно вва-ють відповідної переходу молекул в міцели, т. Е. Критичною концент-
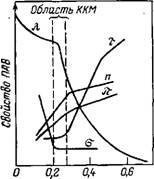
Мал. VI.6. Залежність каламутності т, еквівалент-лентной електропровідності X, поверхнево-го натягу а, показника заломлення п осмотичного тиску я розчину додецил - сульфату натрію в воді від його коіцентра - С,% (мас.) Ції