ДЛЯ ВЧИТЕЛІВ СЕРЕДНІХ ШКІЛ,
СТУДЕНТІВ ПЕДАГОГІЧНИХ ВНЗ І ШКОЛЯРІВ 9-10 КЛАСІВ,
Вирішили присвятити СЕБЕ ХІМІЇ І природознавства
ПІДРУЧНИК задачник ЛАБОРАТОРНИЙ ПРАКТИКУМ НАУКОВІ РОЗПОВІДІ ДЛЯ ЧИТАННЯ
§ 6.1. Розчини, концентрація, розчинність
Існують речовини з необмеженою здатністю розчинятися один в одному (наприклад, сірчана кислота і вода або етиловий спирт і вода) і з обмеженою здатністю. Для кількісної характеристики однієї речовини обмежено розчинятися в іншому користуються поняттям розчинність. яка виражається концентрацією насиченого розчину.
Насичений розчин виходить, коли подальше розчинення даного компонента в розчині припиняється. У насиченому розчині концентрація даного компонента максимальна при даних умовах. Насичений розчин завжди повинен знаходитися в рівновазі з кристалічним компонентом (осадом). Концентрація цього компонента в розчині називається його розчинність. Розчин, в якому концентрація цього компонента нижче його розчинності, називається ненасиченим.
Розчин, в якому концентрація розчиненої речовини вище його розчинності, називається пересиченим. Такі розчини зазвичай отримують при переохолодженні розчину нижче температури, при якій він стає насиченим.
Іноді говорять про розчинення металів, наприклад натрію у воді або цинку в сірчаної кислоти. Але ми будемо називати розчиненням тільки такий процес, при якому розчинена речовина можна виділити з розчину в його початковому стані такими простими операціями, як випарювання розчинника, перекристалізація і т. П.
Розчинність зручно висловлювати в моль / л, проте часто її висловлюють у відсотках по масі, т. Е. Числом грамів розчиненої речовини в 100 г насиченого розчину. Іноді розчинність виражають числом грамів розчиненої речовини, що припадають на 100 г розчинника.
Рішення
Визначимо масу води в 10 г насиченого розчину NaCl. Приймемо масу хлориду натрію в цьому розчині за х г, тоді маса води буде дорівнює (10 - х) р
Складемо співвідношення:
Звідси 100 / (10 - х) = 31,6 / г. і х = 2,4 г хлориду натрію. Маса води в цьому розчині: 10 - 2,4 = 7,6 м
Для більшості речовин розчинність значно залежить від температури. Для визначення розчинності при різних температурах використовують довідкові таблиці або криві розчинності (рис. 6.1).
Якщо приготувати насичений розчин при температурі t2. містить m2 г речовини на 100 г води, а потім охолодити до температури t1. при якій розчинність становить m1 г, то випаде осад (за умови, що не відбулося переохолодження і не утворився пересичений розчин) масою (m2 - m1) м
Скільки грамів нітрату калію випаде в осад при охолодженні насиченого при температурі 60 ° С розчину нітрату калію у воді до температури 20 ° С (див. Рис. 6.1.)?
Найпростіше розчинність досить розчинних речовин визначається випаровуванням певної кількості розчину і зважуванням маси сухого залишку.
Приклад. Розрахувати розчинність нітрату калію у воді при звичайній температурі (20 ° С), якщо при випаровуванні 50 г насиченого розчину маса сухої солі виявилася рівною 13,02 м
Рішення
Маса нітрату калію в 100 г розчину дорівнює 13,02 • 100/50 = 26,04 м Ця маса нітрату калію припадає на 100 - 26,04 = 73,96 г води в насиченому розчині. Складаємо співвідношення:
Звідки х = 26,04 • 100 / 73,96 = 35,2 м Це і є розчинність, т. Е. Маса розчиненої речовини в насиченому розчині, яка припадає на 100 г води.
На різній розчинності речовин заснований один із способів їх очищення - перекристалізація. Очищення зводиться до розчинення забрудненого речовини у відповідному розчиннику при підвищеній температурі і подальшого виділення кристалів очищаемого речовини з пересичені розчину при більш низькій температурі.
Подивіться на рис. 6.1. Які речовини можна очищати перекристаллизацией? Чи можна цим прийомом очистити хлорид натрію?
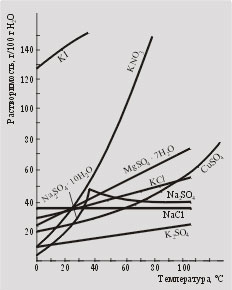
Мал. 6.1.
Криві розчинності речовин
в воді при різних температурах
Насичений розчин, який залишається після відділення випали кристалів, називається маточним. Деяка кількість домішок може піти з осадом. При повторній перекристалізації чистота речовини підвищується.
Розчинність речовини, по суті, є константа рівноваги гетерогенного процесу переходу речовини з кристалічною фази в розчин. У зв'язку з цим за значеннями розчинності при двох температурах легко розрахувати зміни ентальпії (тепловий ефект) і ентропії при розчиненні.
Нехай при температурі Т2 розчинність речовини дорівнює Р2. а при температурі Т1 розчинність дорівнює Р1. Складаємо систему з двох рівнянь c двома невідомими (Н і S):
Потім обчислюємо Н і S.
Приклад. Розчинність хлориду срібла в воді при температурі 10 ° С дорівнює 6,083 • 10 -6 моль / л,
а при 25 ° С - 1,249 • 10 -5 моль / л. Розрахувати зміна ентальпії і ентропії при розчиненні хлориду срібла:
Рішення
Складаємо систему з двох рівнянь:
Знаходимо з першого рівняння:
і підставляємо в друге рівняння:
Отже, ми отримали позитивне значення зміни ентропії при розчиненні хлориду срібла, що показує, що при переході хлориду срібла з кристалічного стану в розчин (у вигляді іонів срібла і хлорид-іонів) відбувається збільшення ступеня безладу в системі.
Знаходимо зміна ентальпії, підставивши значення Sраств = 19,06 Дж / (К • моль) в одне з рівнянь, наприклад:
Нраств = 27 997,048 + 298,2 • 19,06 = 33 681 Дж / моль.
При розчиненні хлориду срібла в воді поглинається 33,68 кДж теплоти на 1 моль цієї речовини.
Хімічний склад природних вод відіграє велике значення в житті людини. Для приготування різних напоїв
необхідна вода, що має строго певні вмісту розчинених речовин.
Абсолютно нерозчинних речовин в природі не існує. Навіть найчистіша на Землі вода озера Байкал містить солі, які вимиваються з гірських порід і грунтів втікає в озеро річками. Дощ і вода снігу, що розтанув - не досконале чиста вода, а вода, що містить 10-20 мг розчинених речовин на 1000 г води. Проте таку воду цілком можна використовувати в технічних цілях, коли потрібно дистильована вода, наприклад для приготування розчину сірчаної кислоти для автомобільного акумулятора.
Якщо воду деякий час витримати в срібному посудині, в воді гинуть майже повністю бактерії. Металеве срібло розчиняється в воді, а іони срібла мають сильну бактерицидну дію. У похідних умовах корисно пити воду з срібного (посрібленого) склянки. Використання срібних столових приладів при їжі також дуже корисно. Знезаражує воду і хлорид срібла, хоча він практично не розчиняється у воді. Такими розчинами можна обробляти невеликі рани.
Природні води відрізняються складом і кількістю розчинених речовин.
Концентрація органічних речовин в річковій воді становить близько 20 мг / л, в океанічній - близько 4 мг / л.
Перерахуйте джерела органічних речовин в природних водах.
Ні в якому разі не намагайтеся запам'ятати числові дані, які будуть приводитися нижче. Постарайтеся порівняти склад деяких вод.
Хімічний склад води озера Байкал (мг / л):

Вода озера Байкал на смак схожа на дистильовану. Зверніть увагу, як мало хлорид-іонів, іонів заліза в цій воді! Спробуйте пояснити, чому в Байкальської воді досить багато гідрокарбонат-іонів і іонів кальцію.
Японія не раз пропонувала купувати байкальскую воду і побудувати для цього трубопровід.
Деякі відомості про озеро Байкал. Вік Байкалу приблизно 25 млн років. Байкал - найглибше водойму на земній кулі, розташований на континенті. Максимальна глибина - 1620 м. Обсяг озера - 23 000 км 3. Води Байкалу прозорі до 40 м. У Байкалі міститься 1/5 світових запасів прісної води.
Озера, що містять неорганічні солі в кількості вище 35 г / л, відносяться до мінеральним. Насичений розчин цих озер називається ропою. Через підвищеної в'язкості високомінералізованих вод поширення тепла від поверхні в глиб води утруднене, тому влітку верхній шар води може нагріватися до температури 50 ° С, взимку вода може не замерзати навіть при -20 ° С.
Озера Байкал можна протиставити інше всесвітньо відоме озеро - Мертве море (Ізраїль, Йорданія) недалеко від Єрусалима. У складі солей переважають хлорид магнію (52%) і хлорид натрію (30%), присутні також хлорид калію і бромід магнію. Звичайно, всі ці речовини у водному розчині перебувають у вигляді іонів, але коли говорять «хлорид магнію», «хлорид натрію» і інші солі, то мають на увазі солі, які утворюються при випаровуванні води. Через високої мінералізації в водах Мертвого моря відсутні живі організми, крім деяких бактерій (збереглися з давніх епох). Вода Мертвого моря і бруду узбережжя володіють високими лікувальними властивостями. Повітря моря насичене парами брому і йоду.
Уявіть собі, що ви працюєте в курортному агентстві. Вам потрібно знати, на яких курортах лікують ті чи інші хвороби. Це стосується складу мінеральних вод. Що ви скажете бажаючому поїхати в П'ятигорськ або Кисловодськ? Або, може бути, краще далеко не їздити, а попити «московську» мінеральну воду?
Склад «московської» мінеральної води (г / л):
Порівняйте склад «московської» мінеральної води зі складом води озера Байкал. Для цього знайдіть однакові іони і висловіть їх концентрації в одних і тих же одиницях виміру.
Кисловодськ славиться своїми джерелами нарзану. Нижче наведено хімічний склад нарзану (г / л) одного з джерел Кисловодська:
Яка відмінність води «Нарзан» від «московської» мінеральної?
Список нових і забутих понять і слів
розчин;
фази змінного складу;
розчинник;
розчинена речовина;
масова частка;
процентна концентрація;
мольная, молярна концентрація;
нормальна концентрація;
розчинність;
насичений, ненасичений, пересичений розчини;
перекристалізація;
матковий розчин;
прісні і солоні природні води.