КОНЦЕПЦІЯ КОРОНАРНОГО, МІОКАРДІАЛЬНОГО, ЦЕРЕБРОВАСКУЛЯРНОГО І ПЕРИФЕРИЧНОГО СУДИННОГО РЕЗЕРВОВ
У виявленні та вивченні локалізації та ступеня вираженості ате- ро-склеротичного ураження судин будь-якої області організму еталонним методом вважається контрастна ангіографія. Ультразвукове дослідження брахіоцефальних артерій і судин кінцівок дозволяє оцінювати морфологічний субстрат ураження і вимірювати швидкість кровотоку. Це, безперечно, вкрай важливі діагностичні показники, однак, будучи зареєстровані в спокої, вони не забезпечують можливості визначення компенсаторних судинних резервів, а саме, здатності судин до розширення і збільшення об'ємної швидкості потоку оксигенированной крові для покриття кисневих запитів органів і тканин при збільшенні їх функціональної активності.В узагальненому вигляді (рис. 4.53) кровоносну судину відчуває кілька впливів різної природи, одні з яких визначають його базальний тонус, а інші - спрямованість його змін різного роду регуляторними впливами, до яких можна віднести наступні [192]:
- Нейрогенні впливу, здатні як підвищувати, так і знижувати судинний тонус.
- Хімічні впливу: а) чинники, які діють зовні на посудину і являють собою, в основному, тканинні метаболіти (метаболічна регуляція); б) фактори, що знаходяться в циркулюючої крові (гормональна регуляція).
- Механічні впливу, наприклад, розтягнення судини під дією змін трансмурального тиску. Активні відповіді є при цьому властивістю розташованих в судинній стінці гладком'язових елементів (міо генна регуляція), які зі
припиняється при підвищенні тиску в посудині і розслабляються при зниженні трансмурального тиску (феномен Остроумова-Бейлісс).
Перераховані види регуляції, одні з яких є дистанційними, а інші - місцевими, в сумі формують зміни гідродинамічного опору того чи іншого відділу судинної системи, що визначають швидкість і обсяг кровотоку через даний судинний басейн.
Нейрогенний контур регуляції, володіючи максимальними швидкісними можливостями, здатний здійснювати загальний циркуляторний гомеостаз організму, забезпечувати незалежність органного кровотоку при різких системних зрушеннях гемодинаміки і, нарешті, здійснювати перебудову розподілу кровотоку в екстремальних ситуаціях, віддаючи пріоритет найбільш життєво важливих органів - головного мозку і серця [193 ].
Відмінною рисою хімічної (гормонально-метаболічної) регуляції є транспортування вазоактивних речовин кров'ю, в принципі, однаково в усі відділи судинної системи, однак нейромедіатори діють лише в тих судинах, де є відповідні еферентні нервові закінчення, які розташовані досить нерівномірно навіть по ходу артерій одного і того ж калібру [192].
Особливостями миогенного контуру регуляції є, по-перше, порівняно повільне спрацьовування гладком'язової клітини на розтяжне зусилля, і, по-друге, залежність сили реакції від швидкості розтягування м'яза [194]. Міогенний контур може брати участь в регуляції кровообігу як на системному і органному, так і на тканинному рівнях.
Всі види і контури регуляції, перебудовуючи по принципам підпорядкування і взаємозамінності, функціонують для кожного органу, регіону і для кровообігу в цілому. Причому кожне з цих контурів може виступати на перший план або "залишатися в тіні" в залежності від конкретної природної або штучно створеної ситуації.
У нормальних умовах опір коронарних артерій регулюється переважно інтрамуральними резистивним судинами. При атеросклерозі, внаслідок зниження еластичності, коронарні артерії втрачають здатність до адекватного розширення у відповідь на збільшення потреби міокарда в кисні. Крім того, пропорційно протяжності стенозу, збільшується площа пошкодженого ендотелію, який синтезує ендотелійзавісімих релаксуючий фактор. Деендотелізація, по-перше, знижує дилатаційною потенціал коронарних судин і робить клітини гладеньких м'язів більш доступними для циркулюючих в крові речовин, що надають констріктор- ве дію, по-друге, служить додатковою перешкодою кро-
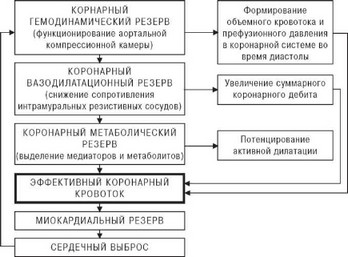
Мал. 4.56. Схема взаємозв'язків механізмів компенсації коронарного кровообігу.
вотока і, по-третє, створює умови для агрегації тромбоцитів і тром- бообразованія [195].
У міру прогресування стенозуючого атеросклерозу, в великих епікардіальних артеріях виникають додаткові ділянки підвищеного опору, що призводить до нерівномірного розподілу кровотоку в міокарді зі зміною ролі резистивних судин. При цьому симпатична стимуляція альфа-2-адренорецепторів в по- стстенотіческой зоні в процесі навантаження може привести до вазокон- стрікціі і викликати ішемію міокарда [196].
Все викладене свідчить про особливе значення точної оцінки дійсної ступеня стенозування коронарних артерій для визначення стратегії і тактики лікування хворого ІХС.
Відповідно до закону J.Poiseuille (цит. За [197]), судинний опір визначається за формулою:
R = (8 х п х l). п r 4, де R - опір; r - радіус перерізу судини; l - довжина звуженої ділянки; п - в'язкість крові, що є практично постійною ве
личиною.
Звідси випливає залежність опору від величини просвіту судини, яка обернено пропорційна четвертого ступеня його радіуса. При звуження судини до половини його діаметру опір збільшується в 16 разів, і тому незначна помилка в оцінці ступеня звуження означає велику помилку в оцінці кровотоку на звуженому ділянці артерії. Орієнтовна різниця судинного опору між фрагментами звуженими на 50 і 70%, є майже 8-кратної, між сужениями на 70 і 80% - 5-кратної, між сужениями на 70 і 90% - 80-кратної [198].
Коронарний резерв.
У зв'язку з викладеними даними серед питань патофізіології ІХС значне місце займає концепція "коронарного резерву" як фізіологічного показника тяжкості стенозу. Незважаючи на часте згадування в літературі, серед дослідників немає одностайності щодо патофізіологічного сенсу цього терміна.
Під коронарним резервом розуміють:
- здатність коронарної судинної мережі збільшувати кровотік адекватно потреби міокарда в даному конкретному випадку [199,200];
- ставлення коронарного опору в умовах спокою до рівня опору при максимально можливій вазодилатації [201];
- ступінь збільшення об'ємної швидкості коронарного кровотоку при незмінному перфузійному тиску і максимальному розширенні коронарних судин [202].
Крім того, виділяють абсолютний коронарний резерв - відношення максимально досяжного коронарного кровотоку (зазвичай під дією вазодилататорів) до вихідного кровотоку, і відносний коронарний резерв - відношення максимально досяжного коронарного кровотоку при наявності стенозу до максимального кровотоку за відсутності стенозу [203].
Мінливий опір вінцевих артерій дозволяє в фізіологічних умовах в будь-який час узгодити об'ємний кровотік з кисневими потребами міокарда. Ця біологічна адаптація допускає збільшення коронарного кровотоку на 300-500% від величини спокою [202]. Але так як у здорових людей навіть посилена фізична робота викликає збільшення потреби
елемент.
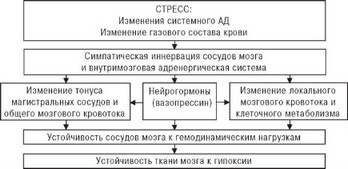
Мал. 4.58. Схема нейрогормонального механізму координації кровопостачання і метаболізму головного мозку.
кисню навантажень будь-якого генезу, що пред'являються міокарду [93].
У зв'язку з цим діагностичний пошук спрямований на визначення динаміки функціонального стану міокарда лівого шлуночка, так як саме він страждає в першу чергу під час епізодів ішемії.
Говорячи про функції міокарда лівого шлуночка, слід пам'ятати, що низька фракція викиду при значній дилатації порожнини шлуночка має на увазі більший ударний обсяг, ніж в разі низької фракції викиду і порожнини шлуночка звичайних розмірів. Тому використання показника фракції викиду для оцінки функціонального стану лівого шлуночка не завжди коректно [202].
Саме з цієї причини для оцінки систолічної функції лівого шлуночка рекомендують використовувати і інші показники: сегментарну скоротливість, кінцевий систолічний об'єм. Зокрема, показано, що саме КСВ лівого шлуночка є основним предиктором виживаності хворих після інфаркту міокарда [221].
У разі невідповідності між потребою міокарда в кисні і його доставкою можуть виникати зони асинергии сегментів лівого шлуночка, що, на тлі штучно викликаної ішемії, дозволяє визначити величину зони ішемізованого міокарда [95,98,102].
Ішемія може також викликати погіршення діастолічної функції лівого шлуночка. При цьому порушується розслаблення миокардиального волокна, збільшується диастолическая жорсткість камери, що призводить до збільшення кінцевого діастолічного тиску, а підвищення пос-Ледней посилює ішемію за рахунок істотного зниження
ходить ще більший відтік крові в неушкоджені ділянки мозку, де настала вазодилатація.
Збочена реакція судин ишемизированной зони на гіпокап- нию, навпаки, веде до появи феномена "зворотного обкрадання" (синдром Робіна Гуда), коли кров з неуражених ділянок, де настала вазоконстрикция, відтікає в судини патологічного вогнища [214].
Останнім часом отримані дані про те, що патологічний вазоспазм - це скоріше патологія ендотелію, що виражається в його тривалому набуханні, а не стан тривалого скорочення гладком'язових волокон медії. Судини з пошкодженим ендотелієм, зокрема, атеросклеротически змінені сонні артерії, має схильність до спазмів і змінюють (перекручують) свою реактивність до ряду агентів, в тому числі, в нормальних умовах володіють судинорозширювальну дію [228].
Що виникає при спазмі пошкодження ендотелію веде до порушення синтезу з арахідонової кислоти простацикліну, що розширює судини (в тому числі мозкові артерії). До інших гуморальним посередникам ангиоспазма відносять синтезується також з арахідонової кислоти в тромбоцитах тромбоксан, і ангіотензин II, серотонін [229,230].
Розвиток ангіохірургії і широке поширення операцій з приводу стенозів і тромбозів внутрішніх сонних артерій гостро поставили питання про необхідність розробки науково обґрунтованих показань до проведення подібних оперативних втручань. До після-
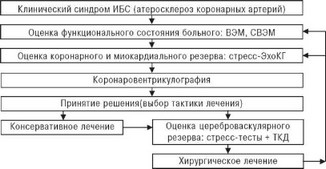
Мал. 4.60. Алгоритм обстеження хворих на ІХС без супутніх ХЦВН і ОААНК. Пояснення в тексті.
днего часу показання до ангіохірургіческіх лікування базуються переважно на клініко-ангіографічних даних без урахування індивідуальних функціональних особливостей мозкового кровообігу.
Впровадження в клінічну практику транскраніальної доплерографії (ТКД) дозволило глибоко вивчити особливості гемодинаміки на інтракраніальних рівні і з якісно нових позицій оцінити вплив окклюзирующих поразок сонних артерій на стан кровотоку в інтракраніальних артеріях.
Оскільки хірургічна корекція мозкового кровотоку спрямована перш за все на профілактику ішемічних порушень мозкового кровообігу, при вирішенні питання про операцію необхідно оцінити ризик розвитку ішемії мозку у кожного конкретного хворого. Необхідно виявлення хворих зі зниженою здатністю до збільшення мозкового кровотоку, тобто хворих, у яких порушений цереброваскулярний резерв [231].
Для оцінки індивідуального функціонального стану цереброваскулярного резерву, тобто збереження адекватних вазоконстрік- раторних і вазодилататорних реакцій мозкових судин, застосовують ряд функціонально-фізіологічних навантажень, які впливають на різні механізми регуляції тонусу артерій мозку [232]. З цією метою використовуються ортостатична, антиортостатическая, нітрогліцериновими, гипоксическая, гиперкапническая, гіпервентіляціонная і
Клінічний синдром ХЦВН (атеросклероз ЕКА)
Оцінка цереброваскулярного резерву: стрес-тести + ТКД