Груздевскіе читання: зв'язок поколінь Актуальні питання сучасної ендоскопії та гастроентерології «Клінічна неврологія - від теорії до практики»: підсумки роботи Фундаментальна та клінічна електрофізіологія серця: до 150-річчя А.Ф. Самойлова



Проведено оцінку ендотоксінеміі і антіендотоксінових гуморального імунної відповіді у 138 хворих на ВІЛ-інфекцію. Встановлено підвищений рівень ендотоксину і відхилення від «норми» концентрацій антитіл до гліколіпідами і ліпополісахаридом E.ColiO14 в крові більшості ВІЛ-інфікованих пацієнтів. Поряд з показниками, що характеризують «хронічну ендотоксінового агресію», у частини хворих виявлені лабораторні маркери синдрому системної запальної відповіді (прозапальні інтерлейкіни 1β, високий рівень антитіл до гліколіпідами).
Intestinal endotoxin as probable inductor of systemic inflammatory response syndrome in HIV-infecion
Endotoxinemia and antiendotoxin humoral immune response in 138 patients with HIV infection was evaluated. Elevated levels of endotoxin are set and the deviations from «normal» concentrations of antibodies to glycolipids and lipopolysaccharide E. Coli O14 in the blood of most HIV-infected patients. Along with the indicators of the «chronic endotoxic aggression," a subset of patients identified laboratory markers of systemic inflammatory response syndrome (proinflammatory interleukins 1β, high levels of antibodies to glycolipids).
Бактеріальні ліпополісахариди (ЛПС), або кишковий ендотоксин, грають важливу роль в регуляції активності імунітету і ініціації запалення [1, 2]. Ця властивість пов'язана зі здатністю глікопіда (ГЛП) Re -хемотіпа, що входить до складу молекули всіх ЛПС, взаємодіяти з рецепторами вродженого імунітету (TLR4) і визначати рівень активності адаптивної імунної системи [3]. Гіперактивація імунітету надлишком ЕТ в загальному кровотоці може бути однією з причин розвитку запалення (в т.ч. аутоімунного та алергічного характеру) [1-3]. Цей феномен, що формується, зокрема, мікробної транслокації, віднесений до числа основних факторів, що сприяють формуванню і прогресуванню імунодефіциту при ВІЛ-інфекції [4-6]. Транслокация мікроорганізмів і мікробних компонентів може виникати в результаті прямого і цитокіни-опосередкованого пошкодження епітелію кишки вірусом імунодефіциту з подальшим підвищенням проникності кишкової стінки, а також за рахунок змін складу пристеночной і порожнинної кишкової мікрофлори [7, 8]. Більш того, встановлено, що найбільш вразливим вже в гострій фазі захворювання є саме «кишковий пул» Т-лімфоцитів (CD4 +) [8]. Він, як показали спостереження, повністю не відновлюється навіть при використанні високоактивної антиретровірусної терапії [9, 10].
З огляду на високу біологічну активність ЕТ, видається цілком ймовірним участь в цьому процесі самого ЕТ, а вірніше, його надлишку, тобто ендотоксіновий агресії кишкового походження (ЕА), яка кваліфікується як «передхвороба» або універсальний фактор патогенезу захворювань людини і тварин [1, 11]. Кишковий ЛПС є своєрідним екзогормоном, який при концентрації від 0,1 до 1,0 EU / ml сироватки виконує адаптивну функцію, тоді як більш високий його рівень сприяє розвитку різних запальних реакцій [12-15].
У дослідження включено 138 пацієнтів з ВІЛ-інфекцією (таблиця 1). В якості нормативних (фізіологічних) показників нами використані дані Г.Г. Енукідзе і співавт. [14], отримані при обстеженні групи 30 здорових волонтерів.
Характеристика пацієнтів досліджуваної групи
Комбіновану антиретровірусну терапію (АРТ) отримували 33 пацієнта (24%). Середня тривалість прийому АРТ в досліджуваній групі (M ± SD) склала 6,8 ± 4,5 місяця.
Концентрація ЕТ в сироватці крові визначалася в EU / ml за допомогою ЛАЛ-тесту (E-toxate, Sigma) в адаптованій до клінічних умов модифікації [1]. Для оцінки показників гуморального ланки антіендотоксінових імунітету (АЕІ) використовувався імуноферментний метод визначення концентрації антитіл (АТ) до найбільш загальним антигенними детерминантам молекули ЛПС - ГЛП і ЛПС E.ColiO14 (ОАЕ) (ЗАТ «КДО»), концентрації інтерлейкіну 1β (ІЛ-1β ) - ІФА ( «Вектор-бест»).
Статистична обробка отриманих даних проводилася з використанням програми Portable Statistica 8. Нормальность розподілу кількісної ознаки в варіаційному ряду оцінювалася за допомогою критерію Шапіро - Уїлки. При порівнянні двох груп використовували критерій Краскела - Уолліса з подальшим попарним зіставленням за допомогою тесту Манна - Уїтні. Для оцінки зв'язку між ознаками застосовувався коефіцієнт рангової кореляції Спірмена. Рівень статистичної значущості р вважали рівним 0,05.
Результати дослідження та їх обговорення
ЕТ присутній в зразках сироватки всіх пацієнтів досліджуваної групи, причому у більшості з них (68,8%) його показники перевищували рівні здорових людей (рис. 1). При цьому среднегрупповие цифри концентрації ЛПС (M ± SD) склали 2,85 ± 2,42 EU / мл і значимо (p<0,0001) превышали показатели контроля (0,19±0,16 EU/мл [14]).
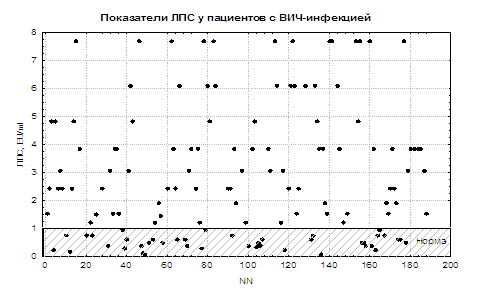
Обрані нами показники АЕІ в фізіологічних умовах досить стабільні з коливаннями концентрації АТ до ГЛП в інтервалі від 190 до 200 у.е.о.п. і АТ до ОАЕ від 380 до 400 у.е.о.п. [14]. Середньогрупові показники антіендотоксінових імунітету в досліджуваній групі (M ± SD: 192,36 ± 150,16 для АТ до ГЛП і 251,94 ± 175,04 для АТ до ОАЕ) не відрізнялися від контролю (М ± SD: 192,62 ± 6 , 03 і 390,67 ± 6,17 відповідно). Проте у більшості ВІЛ-інфікованих АТ до ГЛП і ОАЕ були нижче встановленої «фізіологічної норми» (у 63 і у 81,2% відповідно) (рис. 2 і 3). Лише у 2,9% і у 1,4% хворих концентрації АТ до ГЛП і ОАЕ знаходилися в рамках фізіологічних кордонів.
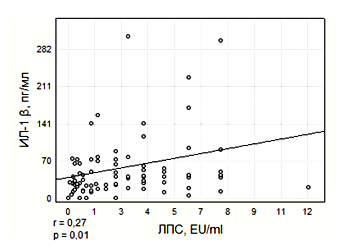
Малюнок 4. Кореляція сироватковоїконцентрації ЛПС з рівнем ІЛ-1β
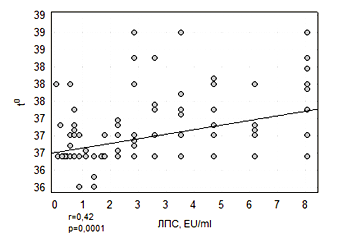
Малюнок 5. Кореляція показників ЛПС з температурою тіла
У науковій літературі є дані про вплив психоактивних речовин (ПАР) на показники ендотоксінеміі [16]. У зв'язку з цим ми оцінили концентрації ЕТ і АТ до нього в трьох групах хворих: вживають алкоголь, вживають героїн і не вживають в даний момент ПАР. Статистично значущої різниці ні по одному з досліджуваних нами показників виявлено не було, що, мабуть, свідчить про те, що вживання ПАР прямо не впливає на концентрацію ЛПС і активність АЕІ.
Оцінюючи можливий зв'язок опортуністичних інфекцій зі змінами в системі «ендотоксин-антіендотоксінових захист» нами проаналізовані показники пацієнтів з ознаками вторинних захворювань. У порівнювані групи включалися тільки хворі з рівнем CD4 + -клітин менше 300 в 1 мкл, які не одержують антиретровірусної терапії. Достовірної кореляції показників концентрації ЛПС і активності АЕІ з наявністю будь-якого опортуністичного захворювання ми не виявили. Даний факт, на наш погляд, може свідчити про універсальність феномена ЕА в популяції ВІЛ-інфікованих пацієнтів.
Таким чином, проведене дослідження дозволило виявити підвищений рівень ЕТ і відхилення від «норми» показників АЕІ в крові більшості ВІЛ-інфікованих пацієнтів. Кишечник, поза всяким сумнівом, - найбільш ємний резервуар грамнегативної бактеріальної флори в організмі, що, поряд з доведеним раніше фактом ВІЛ-індукованого ушкодження кишкового бар'єру [6-8], дозволяє говорити про те, що реєструється в даному випадку ендотоксінемія - «кишкового» походження. Відсутність зв'язку феномена гіперендотоксінеміі з наявністю позакишкових вогнищ бактеріальної природи у спостережуваних хворих частково підтверджує зроблене припущення. Для більшості ВІЛ-інфікованих пацієнтів характерні дуже високі концентрації ЕТ і значне зниження показників АЕІ, що дозволяє констатувати наявність у них хронічної ЕА, яка передбачає одночасне формування «ендотоксіновий толерантності». Подолання ендотоксіновий толерантності додатковою порцією кишкового ЕТ призводить до гіперактивного режиму роботи імунної системи, тобто розвитку ССЗВ, маркером якого, крім провоспалительного інтерлейкіну 1β, є концентрація АТ до ГЛП [17]. Спектр проведених досліджень не дозволяє нам поки однозначно визначати причинно-наслідковий зв'язок або послідовність появи цих змін. Принципово важливо інше: циркуляція в кровотоці підвищених концентрацій ендотоксину дійсно супроводжується розвитком системної запальної відповіді, що реалізується, як відомо, компонентами вродженого імунітету. Цей феномен гіперактивації імунної системи з подальшим її виснаженням розглядається сьогодні багатьма дослідниками як один з ключових в патогенезі імунодефіциту при ВІЛ-інфекції [4, 5, 9]. Класичною ілюстрацією, підтверджує цю точку зору, можна вважати, зокрема, численні спостереження про порівняно благополучному перебігу інфекції вірусу імунодефіциту мавп у нижчих приматів - димчастих мангобеїв, у яких дуже висока «вірусне навантаження» при відсутності ознак підвищеної активності імунної системи не призводить до істотного прогресуванню імунодефіциту протягом багатьох років спостереження [18]. У той же час хронічна стимуляція імунної системи в експерименті на мишах сприяє розвитку опортуністичних захворювань навіть за відсутності вірусної інфекції [19].
Все це в кінцевому підсумку дозволяє розглядати перспективи розширення спектру медикаментозних засобів в лікуванні ВІЛ-інфекції саме в цьому напрямку.
1. ендотоксінового агресія є найбільш вірогідним індуктором синдрому системної запальної відповіді у хворих на ВІЛ-інфекцію; вона характерна для більшості хворих на ВІЛ-інфекцію незалежно від наявності опортуністичних інфекцій та вживання ПАР.
2. Гіперактивація імунної системи може бути наслідком чергування гострої (підгострій) і хронічної ендотоксіновий агресії (ендотоксіновий толерантності), про що свідчить досить широкий інтервал коливань концентрації бактеріальних ліпополісахаридів і активності антіендотоксінових імунітету, їх зворотний зв'язок.
Г.Р. Хасанова, О.І. Біккінін, В.А. Анохін, C.В. Халіуллін, М.Ю. Яковлєв
Казанський державний медичний університет
Республіканський центр по профілактиці і боротьбі зі СНІД та інфекційними захворюваннями МОЗ РТ, м.Казань
Російський державний медичний університет, м Москва
Хасанова Гульшат Рашатовна - кандидат медичних наук, доцент кафедри дитячих інфекцій