Гетерогенна хімічна реакція може протікати тільки в тому випадку, якщо відбувається безперервна молекулярна або кон-вектівная дифузія реагентів до поверхні, на якій йде дана реакція, і безперервна зворотна дифузія продуктів реакції.
Швидкість процесу в цілому буде визначатися швидкістю най-більш повільної стадії. Якщо швидкість реакції на поверхні каталізатора більше швидкості дифузії, то швидкість процесу в цілому буде визначатися швидкістю дифузії. Видимий макроскопічна кінетика реакції буде підкорятися уравне-вам, які можна отримати, розглядаючи тільки процеси дифузії, і, отже, не буде відображати дійсної швидкості хі-мічного реакції на поверхні каталізатора. В цьому випадку гово-рят, що процес лежить в дифузії-ційної області. Процес при цьому найчастіше описується рівнянням реакції першого порядку, так як швидкість дифузії прямо пропор-нальних концентрації.
Якщо швидкість хімічної реакції значно менше, ніж швидкість дифузії, то швидкість про-процесу в цілому буде визначатися швидкістю хімічної реакції. В цьому випадку процес лежить в кине-ної області і описується рівнянням кінетики тієї реакції, яка протікає на поверхні каталізатора.
Якщо швидкість дифузії і швидкість хімічної реакції, рассмот-ренние незалежно один від одного, сумірні, то є пере-вихідна область. Один і той же процес в залежності від умов його проведення може лежати в різних областях. Великий вплив на характер протікання гетерогенного хімічного про-процесу чинять тиску реагуючих речовин, швидкості пото-ков, пористість каталізатора і температура.
При зміні температури на 10 ° С швидкість дифузії, як показує досвід, змінюється приблизно в 1,2 рази, а швидкість хімічної реакції - в 3-4 рази. Тому при зниженні температури швидкість хімічної реакції зменшується швидше, ніж швидкість дифузії, і при низьких температурах процес частіше що протікають в кінетичної області.
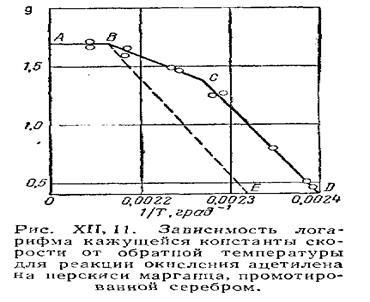
Типова форма залежності логарифма константи швидкості гетерогенного процесу від величини зворотної температури поки-зана на рис. XII, 11. Ділянка кривої АВ, що відповідає практично постійною k (k не залежить від температури), відповідає Діффі-Зіон області протікання процесу. Ділянка СD відповідає кінетичної області протікання процесу. Ця ділянка зазвичай характеризується значною величиною енергії активації. Навчаючи-стік ВС відповідає перехідною області. Зазвичай переходи з однієї області в іншу не так різання, як показано на малюнку, і описуються плавною кривою. Такий хід кривої спостерігається для пористих каталізаторів. На кривих, що характеризують непористі поверхні, перехідна область практично відсутня. Крива в точці В різко змінює напрямок (ВЕ), характеризуючи кине-тичну область протікання процесу.