Формування первинної структури прогормонов або гормонів білково-пептидної природи спочатку - результат прямої трансляції нуклеотиднихпослідовностей відповідних мРНК, що синтезуються на активних ділянках генома гормонпродуцирующих клітин. Структура більшості білкових гормонів або їх попередників формується в полісомах за загальною схемою біосинтезу білка (рис. 26).
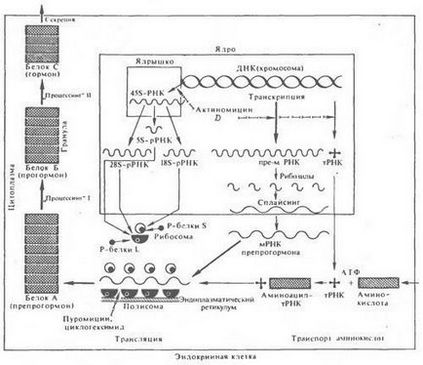
Мал. 26. Синтез білка в тваринної клітині
Синтезується білок в полісомах клітини ендокринної залози - найчастіше за все крупномолекулярний попередник пептидного гормону (препрогормонов)
При цьому можливість синтезу і трансляції мРНК даного гормону або його попередників специфічна для ядерного апарату і полісом певного типу клітин. Так, інсулін і його попередники продукуються в особливих в-клітинах острівців Лангерганса підшлункової залози, глюкагон - в їх а-клітинах, СТГ - в малих еозинофілів аденогипофиза, пролактин - у великих еозинофільних клітинах тієї ж залози, а гонадотропіни - в особливих базофільних клітинах і т.д.
Винятком із загального правила шляхів біогенезу гормональних поліпептидів є біосинтез таких рилізинг-факторів в клітинах гіпоталамуса, як ТРФ і ЛГ-РФ. Синтез цих невеликих пептидів може відбуватися не в полісомах на матриці мРНК, а в розчинній частині цитоплазми під впливом спеціальних для кожного фактора РФ-синтетазної систем, що складаються з комплексу специфічних ферментів (Райклін і ін. 1972, 1973; Йоханссон і ін. 1973).
Пряма трансляція генетичного матеріалу в випадках синтезу більшості поліпептидних гормонів найчастіше призводить до освіти не самого гормону, а його малоактивних попередників - поліпептидних препрогормонов (прегормони).
У такого роду випадках біосинтез поліпептидного гормону складається з двох етапів: 1) рибосомального синтезу неактивного попередника на матриці РНК і 2) посттрансляційних освіти активного гормону. Перший етап протікає обов'язково в клітинах ендокринної залози, другий - здійснюється, як правило, в ендокринній залозі, але може відбуватися і поза нею.
Посттрансляційна активація гормональних попередників (процесинг-білків) може реалізуватися в двох формах: шляхом багатоступінчастої ферментативної деградації молекул трансльованих великомолекулярних попередників зі зменшенням розмірів молекули (або молекул) активируемого гормону (або гормонів) і за рахунок неферментативної асоціації прогормональний субодиниць з укрупненням розмірів молекули активується гормону . Ці шляхи освіти характерні не тільки для гормональних, але і для інших секретується білків (Нейрат, 1977).
Перша форма посттрансляционной активації протікає найчастіше як багатоступінчастий процес, який реалізується за участю специфічних протеаз обмеженої дії. В результаті трансляції під прямим генетичним контролем утворюється в таких випадках крупномолекулярний, короткоживучий попередник препрогормонов. Він зазвичай гидрофобен з N-кінця і легко проникає через мембрани ЕПР, з яким асоційовані синтезують його ансамблі полісом.
При проходженні через мембрани ретикулума відбувається ферментативне відщеплення від прегормона гидрофобного ділянки з N-кінця його молекули, і в цистернах ретикулума утворюються молекули укороченого і більш гідрофільного прогормона. Прогормон переміщається з рідкої частини цитоплазми (цитозоля) в секреторні гранули або секретується в кров у вигляді так званих «великих» гормонів. У крові виявляють, зокрема, «великий» інсулін, «великий» СТГ, «великий» паратгормон і т.д. (Ялоу, 1978. 1979).
У гранулах ендокринної клітини або поза нею прогормон деградує, активується і перетворюється в справжній гормон. Однак активний гормон може в свою чергу бути прогормоном для інших гормональних сполук і перетворюватися в них під дією протеаз периферичних тканин. Схема процесу в загальному вигляді виглядає так:
Схема процесу біосинтезу білково-пептидних гормонів
Протеази обмеженої дії здійснюють опосередкований генетичний контроль біосинтезу гормонів даного типу.
Друга форма посттрансляционной активації здійснюється зазвичай всередині ендокринних клітин і характерна для димеризованих глікопротеїнових гормонів. Схема цих процесів наступна:
Друга форма посттрансляционной активації
Приєднання вуглеводних залишків до субодиницям є ферментативним процесом. Крім того, кожна субодиниця може ферментативно отщепляться від просуб'едініци.
Перша форма активації попередників пептидних гормонів добре вивчена для біосинтезу інсуліну, паратгормону, ангіотензину, в-липотропина, АКТГ і ряду інших білково-пептидних гормонів. Розглянемо ці процеси на прикладі біогенезу інсуліну в в-клітинах острівковогоапарату підшлункової залози (Штейнер та ін. 1969 1976). На першому етапі синтезу даного гормону в полісомах клітин синтезується короткоживучий одноланцюговий пептид, що складається з 104-110 амінокислотних залишків, з М.М.-11500.
Цей короткоживучий білок, що не володіє біологічною актівнос / ма, був названий препроінсуліну або преінсуліном. У ньому з / N-кінця ланцюга є сигнальний гідрофобний 23-членний пептид, з'єднаний з в-ланцюгом майбутнього інсуліну (30 залишків), с кінця розташована А-цспь інсуліну (21 залишок), а між В- і А-ланцюгами знаходиться уставний пептид (30-35 залишків у різних видів) (рис. 27). Сигнальний і уставний пептиди варіабельні у різних видів тварин. У цистернах шорсткого ретикулума на шляху з полісом в секреторні гранули препроинсулин спочатку піддається протеолізу з N-кінця, в результаті чого відщеплюється сигнальний 23-членний пептид, «протягувати» прегормони через мембрану.
В результаті препроинсулин перетворюється в проінсулін - одноланцюговий поліпептид, який складається з 81-86 амінокислотних залишків (М.М - 9500) і має низьку біологічну активність. У секреторних гранулах відбувається перетворення проінсуліну в інсулін шляхом ферментативного вищепленію вставочного пептиду. Даний процес протікає двостадійна за участю двох груп ферментів: специфічної тріпсіноподобних ендопептідази (ферменту), що викликає розщеплення ділянок Apr-Apr і Ліз-Apr; карбоксіпептідазоподобних ферментів (карбоксипептидази В), відщеплюється 3 Apr і 1 Ліз.
В результаті дії цих ферментів утворюється активна дволанцюжкова форма інсуліну (51 амінокислотний залишок, М.М - 5700), молекула зв'язує або С-пептиду (26-31 залишок у різних видів). 3 молекули аргініну і 1 молекула лізину. Сутність механізму активації в даному випадку зводиться до вищепленію з молекули проінсуліну вставочного пептиду, що забезпечує необхідну для прояву високої біологічної активності взаємну просторову орієнтацію ланцюгів А і В, пов'язаних двома дисульфідними містками.
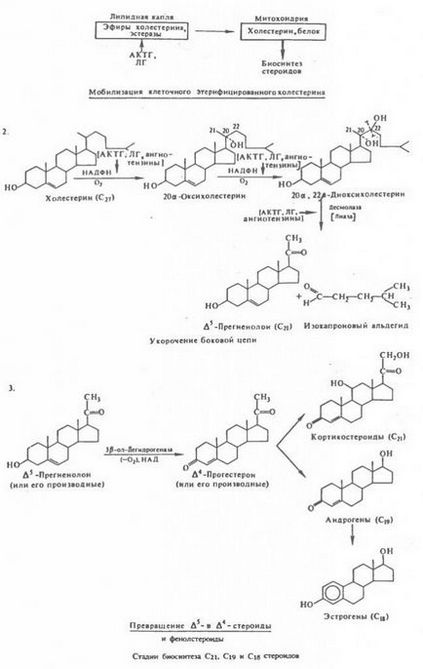
Стадії біосинтезу С21, С19 і C18 стероїдів
Описаний принцип активації білково-пептидних гормонів в процесі їх біосинтезу, мабуть, універсальний, але може варіюватися в деталях деградації молекул попередників і в особливостях тканинної локалізації стадій процесу. Так, одноланцюговий пептид - паратгормон - утворюється в клітинах паращитовидних залоз в результаті послідовної деградації його великомолекулярних попередників з N-кінця їх молекули (Кемпер і ін. 1974, 1976). У полісомах спочатку синтезується препропаратгормон, що складається з 115 амінокислотних залишків. Після відщеплення від N-кінцевій частині прегормона 25-членного гидрофобного фрагмента утвориться паратгормон (90 залишків амінокислот). З прогормона в секреторних гранулах клітин залози утворюється паратгормон після відщеплення 6-членного фрагмента від N-кінця прогормональний молекули.
З преатріопептіда (151 амінокислотний залишок) в міокарді утворюється спочатку проатріопептід в результаті відщеплення з N-кінця 25-членного сигнального фрагмента. З останнього потім вищепляются АНФ (124-151 залишок в прегормони) і кардіоділлатін (26-92 залишку в преформ).