4. Білкова буферна система складається з "білка-підстави" і "білка-солі".
R - СН + Н + # 219; R - СН
Відповідне кислотно-основну рівновагу в середовищах, близьких до нейтральних, зміщене вліво і "білок-основа" переважає.
Основну частину білків плазми крові ( »90%) складають альбуміни і глобуліни. Ізоелектричної точки цих білків (число катіонних і аніонних груп однаково, заряд молекули білка дорівнює нулю) лежать в слабокислою середовищі при рН 4,9 - 6,3, тому в фізіологічних умовах при рН 7,4 білки знаходяться переважно в формах "білок-підставу "і" білок-сіль ".
Буферна ємність, яка визначається білками плазми, залежить від концентрації білків, їх вторинної та третинної структури і числа вільних протон-акцепторних груп. Ця система може нейтралізувати як кислі, так і основні продукти. Однак внаслідок переважання форми "білок-основа" її буферна ємність значно вище за кислоті і становить для альбумінів Вк = 10 ммоль / л, а для глобулінів Вк = 3 ммоль / л.
Буферна ємність вільних амінокислот плазми крові незначна як по кислоті, так і по лугу. Це пов'язано з тим, що майже всі амінокислоти мають значення рКа. дуже далекі від рКа = 7. Тому при фізіологічному значенні рН їх потужність мала. Практично тільки одна амінокислота - гістидин (рКа = 6,0) володіє значним буферним дією при значеннях рН, близьких до рН плазми крові.
Таким чином, потужність буферних систем плазми крові зменшується в напрямку
Еритроцити. У внутрішньому середовищі еритроцитів в нормі підтримується постійний рН, що дорівнює 7,25. Тут також діють водородкарбонатная і фосфатна буферні системи. Однак їх потужність відрізняється від такої в плазмі крові. Крім того, в еритроцитах білкова система гемоглобін-оксигемоглобін грає важливу роль як в процесі дихання (транспортна функція по переносу кисню до тканин і органів і видаленню з них метаболічної СО2), так і в підтримці сталості рН всередині еритроцитів, а в результаті і в крові в цілому. Необхідно відзначить, що ця буферна система в еритроцитах тісно пов'язана з водородкарбонатной системою. Т. к. РН всередині еритроцитів 7,25, то співвідношення концентрацій солі (НСО3 -) і кислоти (Н2 СО3) тут дещо менше, ніж у плазмі крові. І хоча буферна ємність цієї системи по кислоті всередині еритроцитів дещо менше, ніж у плазмі, вона ефективно підтримує сталість рН.
Фосфоліпіди є відносно слабкими кислотами. Значення рКа дисоціації фосфатних груп перебувають у межах від 6,8 до 7,2. Тому при фізіологічному рН 7,25 фосфоліпіди мембран еритроцитів знаходяться як у вигляді неіонізованих, так іонізованих форм. Інакше кажучи, у вигляді слабкої кислоти і її солі. При цьому співвідношення концентрацій солі і слабкої кислоти становить приблизно (1,5 - 4). 1. Отже, сама мембрана еритроцитів має буферним дією, підтримуючи сталість рН внутрішнього середовища еритроцитів.
Таким чином, в підтримці сталості кислотно-лужної рівноваги в крові бере участь ряд буферних систем, що забезпечують кислотно-основний гомеостаз в організмі.
У сучасній клінічній практиці кислотно-лужну рівновагу (КЩР) організму зазвичай визначають шляхом дослідження крові по мікрометод Аструпа і висловлюють в одиницях ВЕ (від лат. "Бі-ексцес" - надлишок підстав). При нормальному кислотно-лужний стан організму ВЕ = 0 (в апараті Аструпа цьому значенню ВЕ відповідає рН 7,4).
При значеннях ВЕ від 0 до ± 3 КЩС організму вважається нормальним, при ВЕ = ± (6 - 9) - тривожним, при ВЕ = ± (10 - 14) - загрозливим, а при абсолютному значенні ВЕ, що перевищує 14, - критичним.
Для корекції КЩР при ВЕ<0 (ацидоз) чаще используют 4%-ный раствор гидрокарбонаната натрия, который вводят внутривенно. Необходимый объем этого раствора в мл рассчитывают по эмпирической формуле v = 0,5mВЕ, где m – масса тела, кг.
Якщо стан ацидозу виникло в результаті короткочасної зупинки серця, то обсяг 4% -ного розчину NаНСО3 (v мл), необхідний для компенсації зсуву КЩР в кислу область, розраховують за формулою v = m z, де z - тривалість зупинки серця, хв.
Корекція КЩР при алкалозі більш складна і вимагає врахування багатьох привхідних обставин. В якості однієї з тимчасових заходів доцільно введення від 5 до 15 мл 5% -го розчину аскорбінової кислоти.
Метод кислотно-основного титрування в одному зі своїх варіантів (алкаліметрія) дозволяє визначати кількості кислот і кислотоутворюючих речовин (солей, складених з катіона слабкої основи і аніона сильної кислоти і т. П.) За допомогою розчинів лужної відомої концентрації, званих робочими. В іншому варіанті (Ацидиметрія) цей метод дозволяє визначати кількості підстав і речовин основного характеру (оксидів, гідридів і нітридів металів, органічних амінів, солей, складених з катіонів сильних основ і аніонів слабких кислот і т. П.) За допомогою робочих розчинів кислот.
Метод кислотно-основного титрування використовується в практиці клінічних, судово-експертних і санітарно-гігієнічних досліджень, а також при оцінці якості лікарських препаратів.
1 Згідно протонної теорії, кислотою називають будь-яка речовина, молекулярні частинки якого (в тому числі і іони) здатні віддавати протон, тобто бути донором протонів; підставою називають будь-яка речовина, молекулярні частинки якого (в тому числі і іони) здатні приєднувати протони, тобто бути акцептором протонів.
Кислотно-основні буферні системи та розчини
Інформація про роботу «Кислотно-основні буферні системи та розчини»
професійних захворювань [27]. 5.1.1 Вимога безпеки в агрохімічної лабораторії Дослідження ґрунтових зразків на кислотно-лужний стан здійснюється в агрохімічної лабораторії. До роботи в агрохімічної лабораторії допускаються особи, які не мають медичних протипоказань і пройшли медичний огляд (при вступі на роботу і періодично в процесі роботи). Чи не.
іонів) і збереженню мас (кількість речовини в цьому розчині залишається постійним, якщо воно не додається або виробляється, не видаляється або руйнується). У нормі в плазмі існує рівновага між катіонами (Na +, K +, Ca ++, Mg ++) і аніонами (Cl -, НСО 3, білки, залишкові аніони). Воно дорівнює 153 ммоль / л і представлено в діаграмі Гембл. При виснаженні бікарбонатних буферних підстав їх.
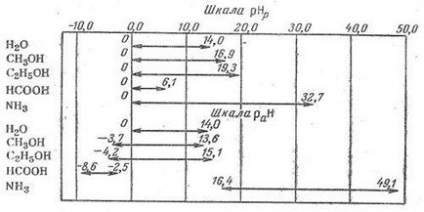
R - СН + Н2О N + Н3 NН2 кислота ВН + поєднане підставу В (сіль білка-підстави) (білок-підставу) 3.2.Определение pH стандартних буферних розчинів Використовувані в якості еталонів для вимірювань розчини введені давно. Одним з перших таких стандартних розчинів використовували «буфер» Вейбеля, який представляв собою розчин.