аутоаллергические хвороби
Аутоаллергические хвороби (грецьке autos сам + алергія) синоніми: аутоімунні, аутоагресивні хвороби) - група захворювань, основним механізмом розвитку яких є реакція аутоантитіл і сенсибілізованих лімфоцитів з власними тканинами. Практично всі клітини і тканини людини при певних умовах можуть бути об'єктом шкідливої дії лімфоцитів і аутоантитіл; тому клінічні симптоми аутоаллергических хвороб надзвичайно різноманітні і можуть проявлятися як органними, так і системними ураженнями.
Виникнення вчення про аутоаллергии як причини хвороб пов'язано з ім'ям І. І. Мечникова. У 1900-1901 рр. І. І. Мечников і його учні експериментально довели можливість продукції антитіл до білків власних клітин організму.
У 1904 р Донат і Ландштейнер (J. Donath, К. Landsteiner) виявили в сироватці крові хворих пароксизмальної холодового гемоглобинурией антитіла, специфічно спрямовані проти власних еритроцитів. У 1908 р Відаль, Абрамі, Брюль (F. Widal, P. Аbrami, M. Brule) виявили аутогемолізіни у хворих придбаної гемолітична анемія. С. С. Головін в 1904 р висловив припущення про аутоімунному патогенезі симпатичної офтальмии. Особливо широке поширення вчення про аутоаллергии отримало починаючи з 40-50-х років 20 ст. При багатьох захворюваннях встановлені аутоаллергические механізми патогенезу. Слід, однак, строго розмежовувати аутоаллергические хвороби, де ці механізми вважаються провідними, і аутоаллергические синдроми, що ускладнюють хвороби іншого генезу. Типовими прикладами останніх є постінфарктний синдром, симптоматична аутоімунна анемія при лімфолейкозі, гостра дистрофія печінки при інфекційному гепатиті, аутоаллергические синдроми при опіках і променевої хвороби.
Етіологія. Тканини і клітини організму набувають аутоаллергенов (аутоантигенами) властивості в результаті шкідливого впливу різних чинників навколишнього середовища. Ці ушкодження призводять до вивільнення і потрапляння в загальний кровотік фізіологічно ізольованих компонентів клітин і тканин або до зміни антигенних властивостей білкових структур (дивись Аутоаллергия, аутоантигена). Ушкоджувальними екзогенними факторами можуть бути травма, інсоляція, охолодження, інфекція бактеріальна і особливо вірусна, оскільки саме віруси мають здатність проникати в клітини і різко змінювати структуру внутрішньоклітинного білка. Деякі лікарські речовини, володіючи тропизмом до певних клітин крові, стають гаптенами, що входять до складу аутоантигенов. За останні роки отримала підтвердження теорія загальних антигенних детермінант певних штамів мікроорганізмів і тканин людини. Наявність таких детермінант призводить до сенсибілізації не тільки по відношенню до мікробів, але і по відношенню до власних тканин з подальшим їх пошкодженням.
Виділено штами стрептокока групи А, які мають спільні антигени з тканиною серця людини, а також нефритогенні штами стрептокока, колітогенние штами кишкової палички.
При багатьох аутоаллергических хворобах етіологічні фактори залишаються до наст, часу невідомими. Аутоаллергические хвороби частіше розвиваються у жінок.
Патогенез. Можна виділити три шляхи розвитку аутоаллергических хвороб. Перший шлях - утворення в організмі аутоаллергенов (звільнення ізольованих антигенів - колоїд фолікулів щитовидної залози, мієлін, антигени кришталика, яєчок; денатурація тканин при опіку, променевої хвороби та ін .; утворення комплексних і проміжних антигенів). У відповідь на появу аутоаллергенов включаються імунологічні механізми, спрямовані на інактивацію і видалення цих аутоаллергенов. Ці механізми, будучи в своїй основі захисними, в ряді випадків призводять до ушкодження клітин і тканин. Такий механізм передбачається при тиреоїдиті Хасімото, орхіті, енцефаломієліт.
Другий шлях - дефекти в контролі за імунологічними механізмами захисту організму - пояснює теорія «забороненого клону» по Бернет.
У нормі по відношенню до антигенів власних тканин існує імунологічна толерантність (дивись Толерантність імунологічна) і розвиток клонів лімфоїдних клітин, котторий могли б брати участь в імунологічних реакціях з власними тканинами, або загальмовано, або ці клони елімінувати. При патології в силу поки невідомих причин можливий розвиток такого клону, або такий клон з'являється в результаті соматичної мутації лимфоцита. Клітини такого клону починають пошкоджувати тканини організму за механізмом «трансплантат проти господаря» (дивись Несумісність імунологічна). У реалізації такого шляху розвитку аутоаллергические хвороби надають великого значення генетичному факторі, вважаючи, що завдяки генетичних порушень функціонують так звані заборонені клони імунокомпетентних клітин, що продукують аутоантитіла. В якості фактів, які б підтверджували роль генетичного фактора, наводяться випадки сімейного ревматизму, виявлення ревматоїдного фактора у родичів хворих на ревматоїдний артрит, антитіл до тиреоглобуліну у родичів хворих на аутоімунний тиреоїдит, поодинокі спостереження системного червоного вовчака та інших аутоаллергических хвороб у однояйцевих близнюків. Однак цих фактів ще не досить, щоб з упевненістю віднести аутоаллергические хвороби до групи генетичних.
Третій шлях розвитку аутоаллергических хвороб - активація імунологічних механізмів проти мікрофлори, що має загальні антигени з антигенами макро організму. У процесі пристосування до існування в макро організмі у багатьох мікробів з'явилися антигени, спільні з антигенами господаря. Це гальмує включення імунологічних механізмів захисту проти такої мікрофлори, так як по відношенню до своїх антигенів в організмі існує імунологічна толерантність і такі мікробні антигени приймаються як свої. Однак в силу якихось відмінностей в строе¬ніі загальних антигенів все ж відбувається включення імунологічних механізмів захисту проти мікрофлори, що одночасно веде і до пошкодження власних тканин. Припускають участь такого механізму в розвитку ревматизму в зв'язку з наявністю загальних антигенів у деяких штамів стрептокока групи А і в тканини серця, виразкового коліту в зв'язку з наявністю загальних антигенів у слизовій оболонці товстої кишки і у деяких штамів Е. coli, в деяких випадках інфекційно алергічної форми бронхіальної астми у зв'язку з наявністю загальних антигенів в тканини легені і у мікрофлори, вегетуючій в дихальних шляхах.
Незалежно від патогенетичного шляху розвитку аутоаллергические хвороби пошкодження тканин може викликатися чотирма імунологічними (алергічними) механізмами. З них три механізму хімергіческіе, тобто пов'язані з дією аутоантитіл, і четвертий - китергические, або клітинний (дивись Алергія). Перший механізм пошкодження пов'язаний з утворенням алергічних антитіл типу реагинов, які фіксуються на поверхні клітин і при з'єднанні з алергеном викликають звільнення вазоактивних амінів. Останні викликають порушення мікроциркуляції і інші пошкодження. Другий механізм - цитотоксичний. Утворилися антитіла з'єднуються з відповідними клітинами і ока¬зивают на них цитотоксическое і цитолитическое дію двома шляхами. Прямий шлях реалізується через активацію всіх компонентів комплементу. Непрямий шлях включає участь в цьому процесі нейтрофілів, які звільняють фактори, що ушкоджують. Третій механізм - токсична дія імунного комплексу антиген + антитіло. Цей комплекс фіксується в тканинах, особливо в стінках кровоносних судин. Преципитат фіксує і активує комплемент. Це веде до акумуляції в даній тканини нейтрофілів, які фагоцитують комплекс і при цьому виділяють гідролази і інші чинники, що викликають пошкодження тканин. Четвертий механізм - алергічна реакція уповільненого типу. Всі чотири механізму можуть брати участь в пошкодженні тканин, однак при різних аутоаллергических хворобах діє переважно один з них. Участь першого механізму в розвитку аутоаллергических хворобах незначно. Шкідлива дія цитотоксичних аутоантитіл (другий механізм) найбільш чітко демонструється при аутоаллергических хворобах крові, шкідливу дію імунних комплексів - при вузликовому периартеріїт, системний червоний вовчак; клітинний механізм - при аутоаллергических тиреоїдиті, симпатичної офтальмии.
Фактором, що сприяє розвитку аутоаллергических хвороб, є порушення функції залоз внутрішньої секреції. Так, наприклад, при аутоаллергических хвороби часто виявляється глюкокортикоїдна недостатність.
Иммуноморфологических вивчення аутоімунних процесів і хвороб засноване на обов'язковому зіставленні даних морфологічного і імунологічного (функціонального) досліджень. Це означає, що морфологія змін у вогнищі імунної реакції оцінюється паралельно з допомогою імунологічних (рівень антитіл і антигенів в крові, сечі, лімфі) і морфологічних показників стану імунокомпетентних системи.
Для иммуноморфологических вивчення аутоімунних процесів і хвороб використовують три методи: 1) иммуногистохимический (імуно-флуоресцентний) метод в різних його модифікаціях з використанням поєднання люминесцирующих антитіл або антигенів з радіоактивними мітками і «контрастують» маркерами і залученням для цього кількісної оцінки специфічної люмінесценції (мікрофлюоріметріі) ; 2) мікроскопічний метод (світлова, поляризаційна, електронна мікроскопія) в поєднанні з гистохимическими реакціями; 3) імунологічний метод (виявлення антигенів і антитіл в тканинах і рідинах організму). Провідне місце серед них займає иммуногистохимический метод, який служить не тільки для виявлення імунних комплексів, а й для їх «розшифровки» (ідентифікація антигену, антитіла, комплементу).
Морфологія напруженого імуногенезу при аутоімунних процесах і хворобах досить стереотипна, хоча і залежить від особливостей іммуноло¬гіческой ситуації і тривалості антигенної стимуляції. Вона представлена лімфоретікулярной гіперплазію і плазмоцитарна-макрофагальної трансформацією з накопиченням клітин, багатих РНК (імунобласти, піронінофільних клітини, плазматичні клітини) і полісахариди (PAS-клітини, макрофаги та інші), перш за все в органах иммунокомпетентной системи (гіперплазія лімф, вузлів, селезінки і іншого) що відображає процеси клітинної секреції імуноглобулінів (антителообразование) і продукцію рециркулює сенсибілізованих лімфоцитів. Гіперпластичні реакції з накопиченням лімфоретікулярной елементів і плазмоцитарна-макрофагальної трансформацією при аутоімунних процесах і хворобах, як правило, виходять за межі лімфоїдної тканини. Вони яскраво представлені в ретикулоендотеліальної (ретикулогистиоцитарной) системі печінки, легенів, нирок, пухкої сполучної тканини і можуть імітувати картини проміжного запалення і продуктивних васкулітів (якщо керуватися формально-морфологічними ознаками). Виявом напруженого імуногенезу слід вважати і нерідко зустрічається миелоз внутрішніх органів. Процеси клітинної проліферації, плазмоцитарна-макрофагальної трансформації і мієлоїдної метаплазії супроводжуються різкими порушеннями тканинного обміну, завершуються в ряді випадків розвитком тканинного диспротеїнозу (накопичення PAS-поклади-ного матеріалу в лімфатичних, вузлах, амілоїдоз селезінки, нирок і так далі).
Морфологія місцевого пошкодження в зв'язку з імунологічної реакцією визначається при аутоімунних процесах і хворобах як природою антигену (перехресно реагує, АУТОЛОГІЧНОЇ), тривалістю його циркуляції в крові, так і якістю імунного комплексу (циркулює комплементсвязивающіе або местнообразованний за рахунок структурного антигену тканини). При цьому циркулюючі комплементсвязивающіе імунні комплекси здатні зазвичай викликати гіперергічними (імунне) запалення по типу негайної алергії, а местнообразующіеся імунні комплекси, що містять тканинної антиген, частіше ведуть до розвитку змін за типом сповільненої алергії (дивись Алергія). Однак це лише крайні морфологічні вираження місцевих імунологічних реакцій. Доведено, що при аутоімунних процесах і хворобах, індукованих антигеном з утворенням циркулюючих в крові комплементсвязивающіх імунних комплексів, воспалітель¬ние судинні і тканинні зміни, що завершуються фибрино-подібним некрозом, розвиваються в зв'язку з гистопатогенное дією цих комплексів, що знаходить підтвердження при імунофлюоресцентному дослідженні біопсій . При цьому специфіка розвиваються імунних пошкоджень в значній мірі заві¬сіт від хім. структури і величини імунного комплексу. Наприклад, гістологічні та гістохімічні особливості вівчакових змін (гематоксилінові тільця, каріорексис, вилуговування ядер, різка піронінофіліі і інше) пов'язані насамперед з особливістю циркулюючого при вовчаку імунного комплексу, що містить продукти розпаду клітинних ядер, нуклеопротеїни (антиген) і γG-глобуліни (антинуклеарні антитіла ). Специфіка морфологічних змін при ревматоїдному артриті також визначається особливістю аутологичного імунного комплексу і місцем його освіти. Встановлено, що плазматичні клітини синовіальних оболонок при ревматоїдному артриті виробляють аномальні аутоантигенами γG-глобуліни, що веде до появи антитіл до цього глобуліну (γM-імуноглобуліни), утворення ревматоїдного фактора, осадження комплементсвязивающіе крупномолекулярний імунного комплексу і розвитку запально-некротичних змін. З парапротеіноіой макромолекулярной природою імунного комплексу пов'язаний розвиток часто зустрічається при ревматоїдному артриті амілоїдозу.
При істинних аутоімунних захворюваннях (хвороба Хасімото, ідіопатична аддисонова хвороба, енцефалопатія, поліневрит, множинний склероз, асперматогонія і інші), індукованих органосноціфіческім аутологічних антигеном, переважають клітинні тканинні реакції. Морфологія гіперчутливості уповільненої типу у вигляді лімфогістіоцитарною і макрофагальної реакції стає в цих випадках домінуючою (лімфоцитарний тиреоїдит як морфологічне вираження хвороби Хасімото). Хронічний абактеріальний гломерулонефрит, який має морфологію мембранозного або мембранозно-проліфсратівного (мезангіального-мембранозного), може також розглядатися як аутоімунний, так як в розвитку його важливу роль відіграє структурний антиген базальної мембрани гломерулярного фільтра. При різних аутоімунних процесах і хворобах нерідкі поєднання морфології алергії як негайного, так і уповільненого типу.
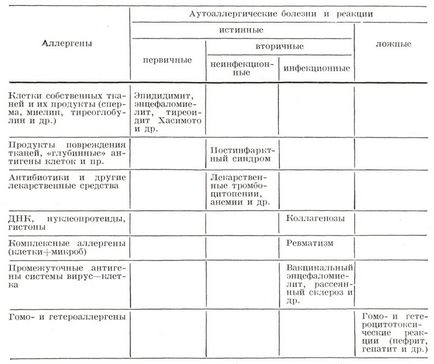
Класифікація. У зв'язку з тим, що багато проблем етіології і патогенезу аутоімунних хвороб ще недостатньо вивчені, загальноприйнятою їх класифікації не існує. В якості робочої може бути використана класифікація В. І. Іоффе (1963), в якій зроблена спроба розділити всі аутоімунні хвороби за характером аутоантигенов і механізмам алергічного (імунологічного) процесу і показати ступінь участі аутоаллергического процесу в розвитку захворювання.
Основним недоліком цієї класифікації є нечітке і неповне для сучасного рівня знань виклад механізму аутоаллергических процесів. Згідно з цією класифікацією першу групу складають справжні аутоімунні хвороби. Сюди включені захворювання, викликані порушенням фізіологічної ізоляції антигенів, по відношенню до яких в організмі немає імунологічної толерантності. Роль же аутоантитіл, які, як і поранило, вдається виявити в сироватці хворих, невідома, так як тканинні зміни мають характер алергічної реакції сповільненого типу. До цієї групи з певною часткою ймовірності можна віднести наступні хвороби: симпатичну офтальмию, аутоалергічних тиреоїдит Хасімото (дивись Хасімото хвороба), демієлінізуючі процеси - енцефаломієліт, розсіяний склероз, деякі форми поліневриту, орхіту, ідіопатичну аддісонову хвороба.
До другої групи належать придбана гемолітична анемія, тромбоцитопенічна пурпура (дивись Пурпура тромбоцитопенічна) і колагенові хвороби. Антигени при цих захворюваннях не володіють органної специфічністю. Патогенез пов'язаний з порушенням гомеостатичного контролю імунологічних механізмів. Безсумнівно, що не всі аутоімунні хвороби, що включаються в цю групу, мають у своїй основі порушення гомеостазу імуногенезу. Так, наприклад, група коллагенозов включає ряд нозологічних форм, мабуть, з різним механізмом і різним ступенем порушення гомеостатичних механізмів імуногенезу. Найбільш доказательна його провідна роль при системний червоний вовчак.
До третьої групи аутоімунних хвороб відносяться гломерулонефрит, гепатит, агранулоцитоз. Сюди включені хвороби, при яких аутоантигенами тканин купується за рахунок шкідливої дії зовнішніх факторів (бактерій, вірусів, ліків) з утворенням комплексних і проміжних аутоаллергенов. До цієї групи можна віднести також ревматизм і вакцинальний енцефаломієліт.
Більш широка класифікація А. Д. Адо (1970) включає не тільки аутоімунні хвороби, а й аутоаллергические реакції (дивись таблицю). В основу цієї класифікації покладено уявлення про характер аутоаллергенов (аутоантигенов), що беруть участь в аутоаллергических процесі, і про найзагальніших рисах його патогенезу. По патогенезу все аутоаллергические реакції розділені на дві групи: 1) справжні, що викликаються активно освіченими в організмі аутоантителами і сенсибілізованими лімфоцитами; 2) неправдиві, викликані введенням в організм готових антитіл.
Таблиця. Аутоаллергические хвороби і реакції, їх зв'язок з характером Аллегені