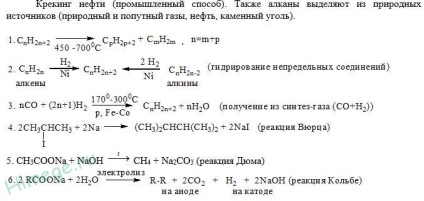
Алкани - вуглеводні, в молекулах яких атоми пов'язані одинарними зв'язками і які відповідають загальній формулі Cn H2n + 2.
У молекулах алканів всі атоми вуглецю знаходяться в стані sр 3-гібридизації. Це означає, що всі чотири гібридні орбіталі атома вуглецю однакові за формою, енергії і спрямовані в кути равносторонней трикутної піраміди - тетраедра. Кути між орбиталями рівні 109 ° 28 '.
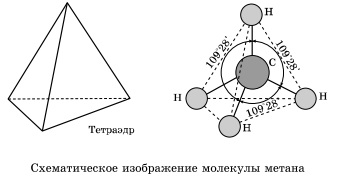
Навколо одинарної вуглець-вуглецевого зв'язку можливо практично вільне обертання, і молекули алканів можуть набувати найрізноманітнішу форму з кутами при атомах вуглецю, близькими до тетраєдраїческому (109 ° 28 '), наприклад, в молекулі н -пентана.
Особливо варто нагадати про зв'язки в молекулах алканів. Все зв'язку в молекулах граничних вуглеводнів одинарні. Перекриття відбувається по осі,
з'єднує ядра атомів, т. е. це σ-зв'язку. Зв'язки вуглець - вуглець є неполярними і погано поляризованість. Довжина С-С зв'язку в алканах дорівнює 0,154 нм (1,54 • 10 - 10 м). Зв'язки С-Н дещо коротший. Електронна щільність трохи зміщена в бік більш електронегативного атома вуглецю, т. Е. Зв'язок С-Н є слабополярной.
Відсутність в молекулах граничних вуглеводнів полярних зв'язків призводить до того, що вони погано розчиняються у воді, не вступають у взаємодію з зарядженими частинками (іонами). Найбільш характерними для алканів є реакції, що протікають за участю вільних радикалів.
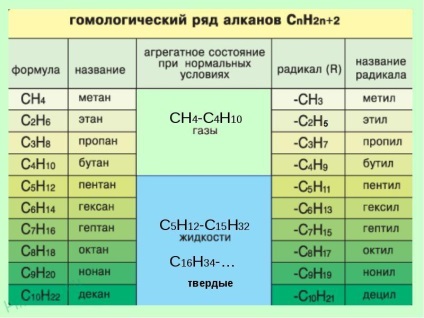
Відповідний ряд метану
Гомологи - речовини, подібні за будовою і властивостями і відрізняються на одну або більше груп СН2.
Ізомерія і номенклатура
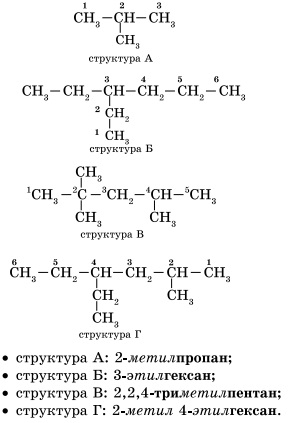
Для алканів характерна так звана структурна ізомерія. Структурні ізомери відрізняються один від одного будовою вуглецевого скелета. Найпростіший алкан, для якого характерні структурні ізомери, - це бутан.
основи номенклатури
1. Вибір головного ланцюга. Формування назви вуглеводню починається з визначення головного ланцюга - найдовшого ланцюжка атомів вуглецю в молекулі, яка є як би її основою.
2. Нумерація атомів головного ланцюга. Атомам головного ланцюга привласнюють номери. Нумерація атомів головного ланцюга починається з того кінця, до якого ближче стоїть заступник (структури А, Б). Якщо заступники перебувають на рівному віддаленні від кінця ланцюга, то нумерація починається від того кінця, при якому їх більше (структура В). Якщо різні заступники перебувають на рівному віддаленні від кінців ланцюга, то нумерація починається з того кінця, до якого ближче старший (структура Г). Старшинство вуглеводневих заступників визначається по тому, в якому порядку слід в алфавіті буква, з якої починається їх назва: метил (-СН3), потім етил (-СН2 -СН3), пропив (-СН2 -СН2 -СН3) і т. Д.
Зверніть увагу на те, що назва заступника формується заміною суфікса-ан на суфікс іл в назві відповідного алкана.
3. Формування назви. На початку назви вказують цифри - номера атомів вуглецю, при яких знаходяться заступники. Якщо при цьому атомі знаходяться кілька заступників, то відповідний номер в назві повторюється двічі через кому (2,2-). Після номера через дефіс вказують кількість заступників (ді - два, три - три, тетра - чотири, пента - п'ять) і назва заступника (метил, етил, пропив). Потім без пробілів і дефісів - назва головного ланцюга. Головний ланцюг називається як вуглеводень - член гомологічного ряду метану (метан СН4. Етан С2 Н6. Пропан C3 H8. Бутан С4 Н10, пентан С5 Н12. Гексан С6 Н14. Гептан C7 H16, октан C8 H18, нонан С9 Н20, декан С10 Н22) .
Фізичні властивості алканів
Перші чотири представники гомологічного ряду метану - гази. Найпростіший з них - метан - газ без кольору, смаку і запаху (запах «газу», відчувши який, треба дзвонити 04, визначається запахом меркаптанів - сірковмісних сполук, спеціально додаються до метану, що використовується в побутових і промислових газових приладах для того, щоб люди , що знаходяться поруч з ними, могли по запаху визначити витік).
Вуглеводні складу від С4 Н12 до С15 Н32 - рідини; важчі вуглеводні - тверді речовини. Температури кипіння і плавлення алканів поступово збільшуються зі зростанням довжини вуглецевого ланцюга. Всі вуглеводні погано розчиняються у воді, рідкі вуглеводні є поширеними органічними розчинниками.
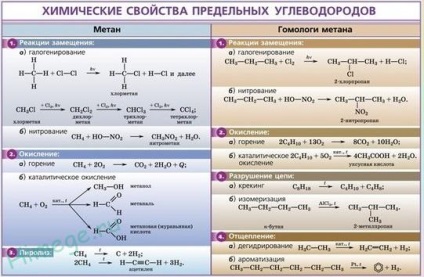
Хімічні властивості алканів
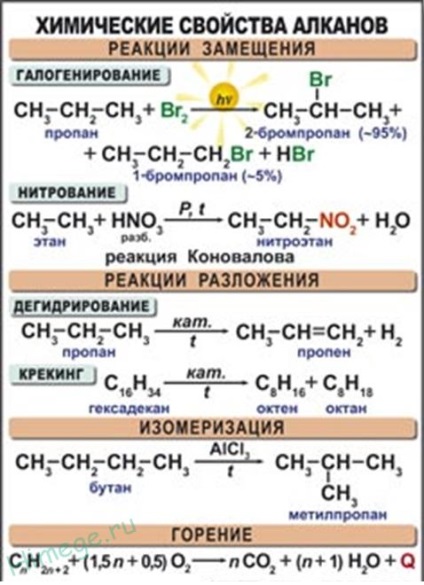
Реакції заміщення.
Найбільш характерними для алканів є реакції вільнорадикального заміщення, в ході якого атом водню заміщується на галоген або будь-яку групу. Наведемо рівняння характерних реакцій галогенування:

У разі надлишку галогену хлорування може піти далі, аж до повного заміщення всіх атомів водню на хлор:
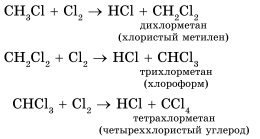
Отримані речовини широко використовуються як розчинники і вихідні речовини в органічних синтезах.
Реакція дегидрирования (відщеплення водню).
В ході пропускання алканів над каталізатором (Pt, Ni, А12 03. СГ2 03) при високій температурі (400-600 ° С) відбувається відщеплення молекули водню і утворення алкена:
Реакції, що супроводжуються руйнуванням вуглецевого ланцюга.
Всі граничні вуглеводні горять з утворенням вуглекислого газу і води. Газоподібні вуглеводні, змішані з повітрям в певних співвідношеннях, можуть вибухати.
1. Горіння граничних вуглеводнів - це вільнорадикальних екзотермічна реакція, яка має дуже велике значення при використанні алканів в якості палива:
У загальному вигляді реакцію горіння алканів можна записати в такий спосіб:
2. Термічна розщеплення вуглеводнів.
Процес протікає по свободнорадикальному механізму. Підвищення температури призводить до гомолитически розриву вуглець-вуглецевого зв'язку і утворення вільних радикалів.
Ці радикали взаємодіють між собою, обмінюючись атомом водню, з утворенням молекули алкана і молекули алкена:
Реакції термічного розщеплення лежать в основі промислового процесу - крекінгу вуглеводнів. Цей процес є важливою стадією переробки нафти.
3. Піроліз. При нагріванні метану до температури 1000 ° С починається піроліз метану - розкладання на прості речовини:
При нагріванні до температури 1500 ° С можливе утворення ацетилену:
4. Ізомеризація. При нагріванні лінійних вуглеводнів з каталізатором ізомеризації (хлоридом алюмінію) відбувається утворення речовин з розгалуженим вуглецевим скелетом:
5. Ароматизація. Алкани з шістьма або більше вуглецевими атомами в ланцюзі в присутності каталізатора циклизующихся з утворенням бензолу і його похідних:
Алкани вступають в реакції, що протікають по свободнорадикальному механізму, т. К. Все атоми вуглецю в молекулах алканів знаходяться в стані sp 3-гібридизації. Молекули цих речовин побудовані за допомогою ковалентних неполярних С-С (вуглець - вуглець) зв'язків і слабополярная С-Н (вуглець - водень) зв'язків. У них немає ділянок з підвищеною і зі зниженою електронною щільністю, легко поляризованих зв'язків, т. Е. Таких зв'язків, електронна щільність в яких може зміщуватися під дією зовнішніх чинників (електростатичних полів іонів). Отже, алкани не реагуватимуть з зарядженими частинками, т. К. Зв'язку в молекулах алканів розриваються по гетеролітичні механізму.
способи отримання